
Compteur de cellules
Au compteur de cellules : Cellules HEK293-GFP
Les cellules 293 de rein embryonnaire humain, également appelées cellules HEK293, cellules 293, voire même cellules HEK, sont une lignée cellulaire dérivée de rein embryonnaire humain. Au début des années 1970, Alex van der Eb a isolé ces cellules dans son laboratoire à l’Université de Leiden, aux Pays-Bas, et un autre membre de son laboratoire les a transformées au moyen d’un adénovirus, fournissant la lignée cellulaire utilisée aujourd’hui. Les cellules HEK293 sont faciles à cultiver et à transfecter. Elles sont donc largement utilisées dans les expériences basées sur la transfection, l’expression des protéines et la production de vaccins. Nous avons imagé des cellules HEK293 transformées par un lentivirus au moyen d’une protéine fluorescente verte (GFP; GenTarget Inc.) afin de présenter l’analyse de la confluence des cellules sur le cytomètre d’imagerie SpectraMax MiniMax 300.
Visionner le webinaire StainFree Cell Detection
Télécharger la note d’application StainFree Cell Detection
Télécharger le livre électronique : comptez les cellules comme un-e pro
Figure 1 : Identification StainFree de cellules HEK293-GFP
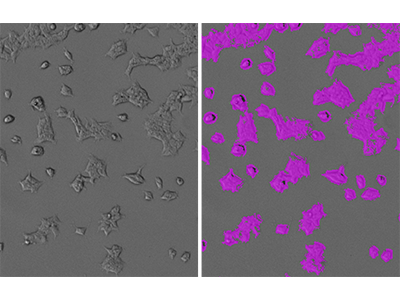
Des cellules HEK293-GFP ont été imagées avec le cytomètre d’imagerie SpectraMax i3 MiniMax 300, et les cellules ont été identifiées à l’aide d’un paramétrage personnalisé d’analyse de terrain. À gauche se trouve l’image par lumière transmise originale, et à droite se trouve la même image avec des masques violets indiquant les zones de confluence identifiées par le logiciel.
Figure 2 : Définition des zones cellulaires et de bruit de fond

Utilisation d'outils de dessin dans le logiciel SoftMax Pro pour définir les zones cellulaires (en jaune) et de bruit de fond (en bleu) des images.
Figure 3 : Cellules HEK293-GFP imagées sur le cytomètre MiniMax
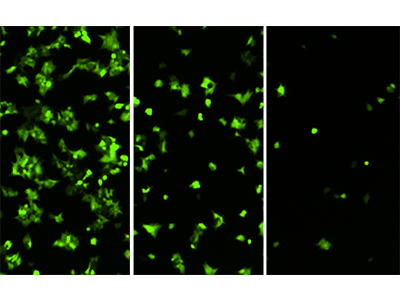
Cellules HEK293-GFP ensemencées à 20000, 5000 et 1250 cellules par puits et imagées dans le canal de fluorescence verte du cytomètre MiniMax.
Figure 4 : Analyse StainFree vs. par fluorescence
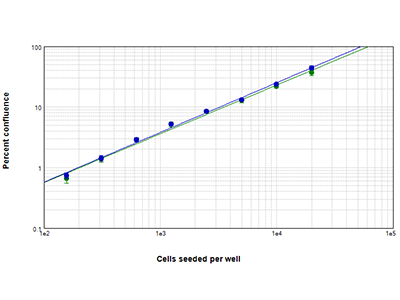
Comparaison des zones de confluence mesurées par analyse StainFree (cercles bleus) et par fluorescence (cercles verts). La confluence StainFree en pourcentage est pratiquement comparable à la confluence analysée par fluorescence.
Astuce 1 :
Parfois, les cellules sont trop agglutinées pour être comptées individuellement. Dans ces cas, le paramétrage Analyse de champ du logiciel SoftMax Pro peut être utilisé pour déterminer les zones couvertes de cellules, ou la confluence en pourcentage. L’analyse StainFree peut être utilisée pour les cellules imagées dans le canal TL. Pour certains types de cellules, un paramétrage Cellules prédéfini dans le logiciel permet d’identifier avec précision et automatiquement les zones couvertes de cellules. Pour les cellules HEK293, ce paramétrage prédéfini fonctionne raisonnablement bien et peut être utilisé pour estimer la confluence à des fins de contrôle de qualité.
Astuce 2 :
Si des estimations légèrement plus précises de la confluence sont nécessaires, un paramétrage personnalisé défini par l’utilisateur peut être la solution. L’un des moyens d'obtenir des mesures précises de la confluence des cellules est le dessin avec l’outil Bruit de fond sur certaines zones qui sont très proches, mais en dehors, des limites des zones de confluence. Cela permet de réduire la zone bordant les cellules qui est comptabilisée comme zone couverte de cellules.
Kit d’outils d’analyse des cellules HEK293-GFP
- Plateforme de détection de microplaques multimode SpectraMax® i3
- Cytomètre d’imagerie SpectraMax®MiniMax™ 300
- Logiciel SoftMax ® Pro Software
Paramétrages de l’instrument
Type d’analyse : Analyse de champ
Longueur d’onde pour la recherche de zones de confluence : TL ou 541
À propos de la technologie StainFree Cell Detection
Les essais d’imagerie cellulaires nécessitent généralement l'utilisation de sondes fluorescentes pouvant se révéler toxiques pour les cellules vivantes ou ne peuvent être utilisées que dans des cellules fixées. Une méthode sans marquage pour analyser les numérations cellulaires et la confluence des cellules vous permet de surveiller quantitativement la prolifération et la santé des cellules sans flux de travail fastidieux pouvant perturber la viabilité cellulaire.
La plateforme de microplaques multimode SpectraMax i3 avec le cytomètre d’imagerie MiniMax 300 utilise la technologie unique StainFree Cell Detection en attente de brevet, qui vous permet de réaliser des essais de prolifération cellulaire, de cytotoxicité et d’autres essais sans colorations nucléaires tels que DAPI, qui s’intercale avec l’ADN, et sans colorants de cellules vivantes qui sont toxiques à long terme pour les cellules.