
Compteur de cellules
Au compteur de cellules : Cellules HT1080
La lignée cellulaire de fibrosarcome HT1080 a été générée en 1972 à partir de tissu de biopsie tumorale. Curieusement, le patient n’avait pas été traité par radiothérapie ou chimiothérapie lors de la biopsie, donc les cellules ne présentaient pas les mutations indésirables qui sont couramment provoquées par ces traitements. Comme les cellules HT1080 sont hautement invasives, elles sont souvent utilisées comme modèles pour la migration et l’invasion cellulaires. Les chercheurs ont pu identifier un certain nombre d’agents thérapeutiques potentiels pour le cancer en se basant sur leur capacité à inhiber le comportement invasif des cellules HT1080.
Visionner le webinaire StainFree Cell Detection
Télécharger la note d’application StainFree Cell Detection
Télécharger le livre électronique : comptez les cellules comme un-e pro
Figure 1 : migration cellulaire par imagerie
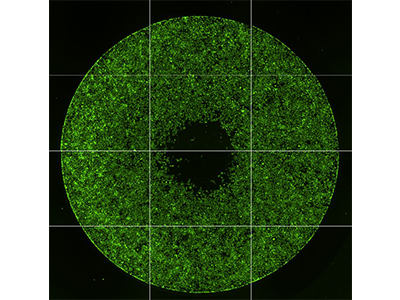
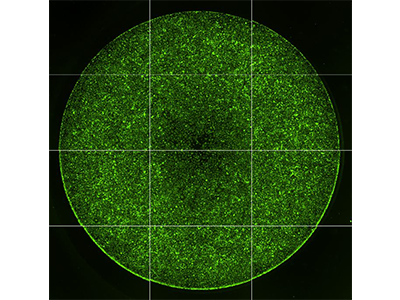
Le test de migration cellulaire Oris™ Pro de Platypus Technologies a été utilisé pour mesurer la migration des cellules HT1080 traitées avec de la cytochalasine D (gauche) ou du contrôle DMSO (droite). Ce test utilise un gel biocompatible non toxique (BCG) de façon à former une zone sans cellule sur les surfaces de culture. Après avoir ensemencé les cellules dans la microplaque à 96 puits, le BCG se dissout, permettant aux cellules de migrer au centre des puits (zone indiquée par des cercles jaunes). Les résultats ont été évalués par imagerie sur le cytomètre d’imagerie SpectraMax MiniMax 300, et les cellules qui avaient migré au centre des puits ont été comptées en utilisant la fonction de sélection de région d’intérêt (ROI) dans le logiciel SoftMax Pro Software.
Figure 2 : Numérations cellulaires StainFree
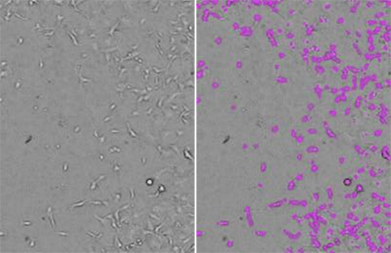
Des cellules HT1080 ont été évaluées par imagerie avec le cytomètre d’imagerie SpectraMax MiniMax 300, et les cellules ont été identifiées à l’aide du paramètre d’analyse prédéfini « CellsD ». À gauche se trouve l’image d'origine par lumière transmise, et à droite se trouve la même image avec des masques violets indiquant les cellules identifiées par le logiciel.
Figure 3 : Quantification de la migration cellulaire
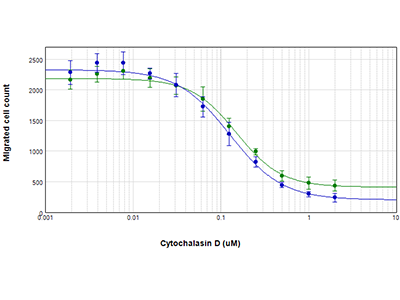
Les cellules ont été traitées avec de la cytochalasine D, et les cellules qui ont par la suite migré au centre des puits ont été comptées au moyen de la technologie StainFree (cercles bleus) ou par analyse cellulaire fluorescente (cercles verts). Les valeurs de CE50 pour la cytochalasine D étaient de 0,13 µm et de 0,15 µm, respectivement, ce qui confirme qu’il est inutile de marquer les cellules pour évaluer avec précision la migration cellulaire avec le test Oris Pro.
Kit d’outils d’analyse des cellules HT1080
- Plateforme de détection de microplaques multimode SpectraMax® i3
- Cytomètre d’imagerie SpectraMax®MiniMax™ 300
- Logiciel SoftMax ® Pro Software
Paramétrages de l’instrument
Type d’analyse : Analyse d'objets discrets
Longueur d’onde pour trouver des objets : TL
À propos de la technologie StainFree Cell Detection
Les essais d’imagerie cellulaires nécessitent généralement l'utilisation de sondes fluorescentes pouvant se révéler toxiques pour les cellules vivantes ou ne peuvent être utilisées que dans des cellules fixées. Une méthode sans marquage pour analyser les numérations cellulaires et la confluence des cellules vous permet de surveiller quantitativement la prolifération et la santé des cellules sans flux de travail fastidieux pouvant perturber la viabilité cellulaire.
La plateforme de microplaques multimode SpectraMax i3 avec le cytomètre d’imagerie MiniMax 300 utilise la technologie unique StainFree Cell Detection en attente de brevet, qui vous permet de réaliser des essais de prolifération cellulaire, de cytotoxicité et d’autres essais sans colorations nucléaires tels que DAPI, qui s’intercale avec l’ADN, et sans colorants de cellules vivantes qui sont toxiques à long terme pour les cellules.