
Compteur de cellules
Au compteur de cellules : Cellules PC-12
Cultivées pour la première fois par Greene et Tischler en 1976, les cellules PC-12 sont issues d’un phéochromocytome (tumeur neuro-endocrinienne) de médullosurrénale de rat. Elles ont été développées comme lignée cellulaire modèle et sont une alternative aux cultures des cellules chromaffines surrénales primaires. Les cellules PC-12 peuvent se différencier en cellules semblables à des neurones en présence d’un facteur de croissance des nerfs ou de déxaméthasone. En raison de leur capacité de différenciation et de leur facilité de culture, les cellules PC-12 sont utilisées dans de nombreux domaines de recherche allant de l’efficacité des médicaments à la neurosécrétion.
Visionner le webinaire StainFree Cell Detection
Télécharger la note d’application StainFree Cell Detection
Télécharger le livre électronique : comptez les cellules comme un-e pro
Figure 1 - Technologie StainFree comparée à la numération cellulaire par fluorescence
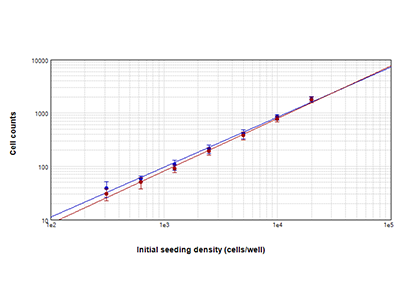
Cellules PC-12 comptées au moyen de la technologie StainFree™ Cell Detection (cercles bleus) et de la coloration nucléaire rouge (cercles rouges). Les numérations obtenues avec ces deux méthodes sont très semblables, démontrant que la technologie StainFree donne des numérations cellulaires précises tout en éliminant la nécessité de recourir aux colorants fluorescents (r2 > 0,99 pour chaque tracé).
Figure 2 - Les courbes de croissance obtenues avec StainFree ont couvert l’analyse de la zone
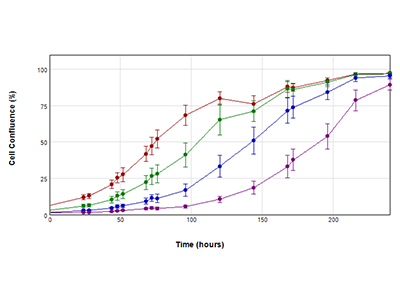
Courbes de croissance de cellules PC-12 sur une période de 10 jours. Les cellules ont été ensemencées à l’origine à raison de 2000 cellules (rouge), 1000 cellules (vert), 500 cellules (bleu) et 200 cellules (violet). La confluence des cellules a été mesurée toutes les 24 heures avec la fonction Analyse de champ du logiciel SoftMax Pro. La diminution observée de la confluence pour la population de densité initiale de 2 000 cellules à 144 heures (*) est probablement due à la diminution des nutriments dans le milieu de culture ; le milieu a été remplacé au départ tous les trois jours, mais à partir de 144 heures, il a été remplacé tous les jours.
Figure 3 - Analyse StainFree de cellules PC-12 avec coloration des mitochondries
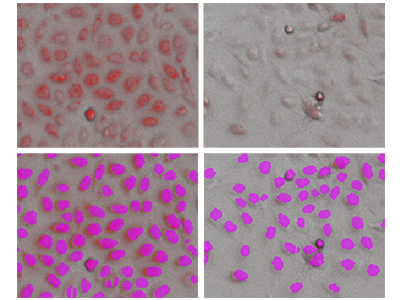
La ligne supérieure montre des images par lumière transmise superposées par des images fluorescentes rouges (de mitochondries). La ligne inférieure montre l’analyse StainFree avec les cellules individuelles (masques violets) identifiées par le logiciel. À gauche, cellules non traitées ; à droite, cellules traitées avec 1 µm de valinomycine. Pour chaque cellule identifiée, l’intensité de la coloration des mitochondries peut être calculée.
Figure 4 - Courbes CI50 pour les cellules PC-12 traitées avec de la valinomycine
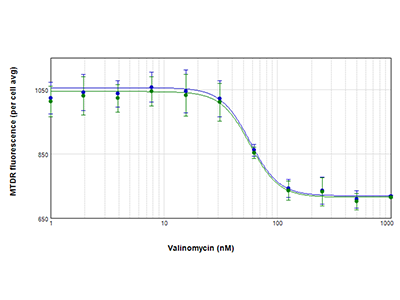
Les cellules PC-12 ont été traitées avec de la valinomycine et testées pour l’activité mitochondriale avec le colorant MitoTracker™ Deep Red FM (MTDR). Les courbes de réponse concentration-dépendantes sont illustrées pour les cellules analysées avec la technologie StainFree (bleu) ou la coloration nucléaire fluorescente (vert) afin d’identifier les cellules individuelles. La fluorescence mitochondriale moyenne par cellule est tracée vs. la concentration en valinomycine. Des courbes pratiquement identiques ont été obtenues avec les deux méthodes d’analyse, et dans les deux cas,, la valeur de CI50 était égale à 57 nm.
Astuce 1 :
Pour compter les cellules PC-12 sans marquage, nous recommandons de créer un nouveau paramétrage en utilisant les outils de dessin du logiciel. Choisissez l’Analyse d'objets discrets, puis utilisez les outils de dessin pour définir les les zones avec cellules et sans cellule dans vos images max et min. Pour obtenir des numérations plus précises dans les amas denses de cellules, essayez de dessiner exactement dans les limites des cellules. À l’inverse, si vous trouvez que le logiciel effectue une surnumération des cellules dans vos images, essayez de dessiner légèrement en dehors des limites des cellules.
Astuce 2 :
Il est facile d’obtenir des courbes de croissance avec la fonction Analyse de champ du logiciel SoftMax Pro. L’analyse de champ calcule la zone couverte par les cellules en pourcentage (confluence) sur les images. La mesure de la confluence des cellules peut être un outil précieux pour un meilleur développement des tests. Par exemple, vous pouvez ensemencer des cellules à deux densités d'essai ou plus, calculer la confluence de vos cellules juste avant l'essai, et après avoir obtenu les résultats de l'essai, déterminer le niveau de confluence qui a donné les meilleurs résultats.
Kit d’outils d’analyse des cellules PC-12
- Plateforme de détection de microplaques multimode SpectraMax® i3
- Cytomètre d'imagerie SpectraMax® MiniMax™ 300
- Logiciel SoftMax® Pro
Paramétrages de l’instrument
À propos de la technologie StainFree Cell Detection
Les essais d’imagerie cellulaires nécessitent généralement l'utilisation de sondes fluorescentes pouvant se révéler toxiques pour les cellules vivantes ou ne peuvent être utilisées que dans des cellules fixées. Une méthode sans marquage pour analyser les numérations cellulaires et la confluence des cellules vous permet de surveiller quantitativement la prolifération et la santé des cellules sans flux de travail fastidieux pouvant perturber la viabilité cellulaire.
La plateforme de microplaques multimode SpectraMax i3 avec le cytomètre d’imagerie MiniMax 300 utilise la technologie unique StainFree Cell Detection en attente de brevet, qui vous permet de réaliser des essais de prolifération cellulaire, de cytotoxicité et d’autres essais sans colorations nucléaires tels que DAPI, qui s’intercale avec l’ADN, et sans colorants de cellules vivantes qui sont toxiques à long terme pour les cellules.