
Compteur de cellules
Au compteur de cellules : Cellules RBL
Le développement de lignées de cellules de la leucémie à basophiles chez le rat (RBL) dans les années 1970 a offert aux chercheurs un système de modèle pratique, quoique imparfait, pour l’étude des mastocytes difficiles à obtenir. Des cellules RBL-2H3 sous-clonées à partir de l’une des lignées cellulaires RBL d’origine ont été utilisées pour étudier les voies biochimiques de sécrétion dans les mastocytes. Certaines lignées cellulaires RBL sont cultivées sous forme de cultures en suspension et d’autres sont adhérentes. Comme la morphologie des cellules dans différentes conditions de développement, voire même dans la même culture, peut varier, la capacité à créer un paramétrage d’analyse StainFree personnalisé est extrêmement utile pour garantir des numérations cellulaires précises !
Visionner le webinaire StainFree Cell Detection
Télécharger la note d’application StainFree Cell Detection
Télécharger le livre électronique : comptez les cellules comme un-e pro
Figure 1 : Numérations cellulaires StainFree
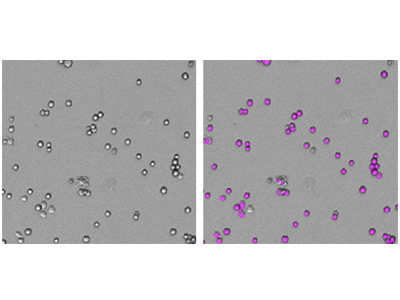
Des cellules RBL-1 ont été imagées avec le cytomètre d’imagerie SpectraMax i3 MiniMax 300, et les cellules ont été identifiées à l’aide d’un paramétrage d’analyse personnalisé défini par l’utilisateur. À gauche se trouve l’image d'origine par lumière transmise, et à droite se trouve la même image avec des masques violets indiquant les cellules identifiées par le logiciel.
Figure 2 : Numérations cellulaires StainFree vs. numérations nucléaires par fluorescence
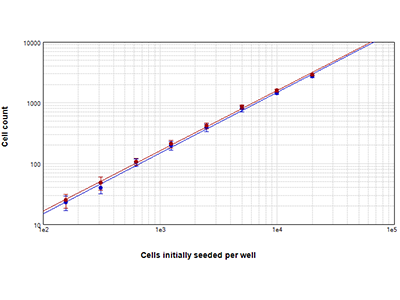
Des cellules RBL-1 ensemencées à des densités comprises entre 156 et 20 000 cellules par puits ont été comptées à l’aide de la technologie StainFree (points bleus), ou elles ont été marquées avec le colorant rouge EarlyTox™ Live et les noyaux fluorescents rouges ont été comptés (points rouges). Les numérations cellulaires obtenues avec les deux méthodes correspondaient étroitement dans toute la plage des densités cellulaires. Les numérations cellulaires ont été effectuées dans une région d’intérêt (ROI) définie par l’utilisateur.
Figure 3 : Essai FLIPR Calcium 6 sur lecteur de microplaques multimode FlexStation 3
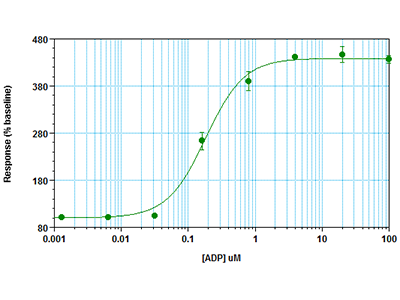
Des cellules RBL-2H3 ont été ensemencées à raison de 30 000 cellules par puits dans une microplaque à 96 puits et ont été incubées pendant la nuit. Le jour suivant, le milieu de croissance a été retiré, le colorant de l'essai FLIPR® Calcium 6 et du probénécide ont été ajoutés aux puits, et les cellules ont été incubées pendant 2 heures. Un essai cinétique de fluorescence a ensuite été effectué sur un lecteur de microplaques multimode FlexStation® 3. Le pipeteur intégré a distribué l’agoniste ADP dans les puits, tandis que le signal fluorescent indiquant la mobilisation du calcium a été simultanément mesuré depuis le fond des puits par le lecteur de plaques.
Figure 4 : Test Fura-2 QBT Calcium sur le lecteur de microplaques multimode3 FlexStation
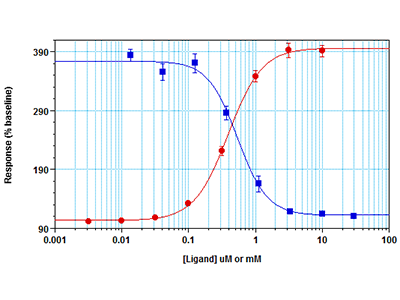
Des cellules RBL-2H3 ont été ensemencées à raison de 30 000 cellules par puits dans une microplaque à 96 puits et ont été incubées pendant la nuit. Le jour suivant, ils ont été chargés avec du colorant Fura-2 QBT™ pendant 60 minutes après avoir retiré le milieu de croissance. Pour les études de CI50, l’inhibiteur YM-58483 a été ajouté aux cellules pendant 45 minutes avant l'essai. Un essai cinétique de fluorescence a ensuite été réalisé sur un lecteur multimode de microplaques FlexStation 3. Le pipeteur intégré a distribué du CaCl2 aux puits à la concentration CE80 (pour l'essai d'inhibiteur, points bleus) ou dans une série de titrage (points rouges). Le signal fluorescent indiquant la mobilisation du calcium a été simultanément mesuré depuis le fond des puits par le lecteur de plaques.
Astuce :
Comme il y a souvent des cellules adhérentes dans les cultures en suspension de cellules RBL, un paramétrage d’analyse créé par l’utilisateur dans le logiciel SoftMax Pro peut être très utile pour « apprendre » au logiciel à identifier uniquement les cellules ayant une morphologie de type suspension et à exclure les cellules fixées. Pour les cultures adhérentes, dont la morphologie peut varier, un paramétrage d’analyse créé par l’utilisateur optimise l’identification de toutes les cellules, quelle que soit leur forme.
Kit d’outils d’analyse des cellules RBL
- Plateforme de détection de microplaques multimode SpectraMax® i3
- Cytomètre d’imagerie SpectraMax®MiniMax™ 300
- Logiciel SoftMax ® Pro Software
Paramétrages de l’instrument pour l’imagerie et la numération cellulaire
Exposition : 7 ms
Réglage de la mise au point : 20 µm
Type d’analyse : Analyse d'objets discrets
Longueur d’onde pour trouver des objets : TL
À propos de la technologie StainFree Cell Detection
Les essais d’imagerie cellulaires nécessitent généralement l'utilisation de sondes fluorescentes pouvant se révéler toxiques pour les cellules vivantes ou ne peuvent être utilisées que dans des cellules fixées. Une méthode sans marquage pour analyser les numérations cellulaires et la confluence des cellules vous permet de surveiller quantitativement la prolifération et la santé des cellules sans flux de travail fastidieux pouvant perturber la viabilité cellulaire.
La plateforme de microplaques multimode SpectraMax i3 avec le cytomètre d’imagerie MiniMax 300 utilise la technologie unique StainFree Cell Detection en attente de brevet, qui vous permet de réaliser des essais de prolifération cellulaire, de cytotoxicité et d’autres essais sans colorations nucléaires tels que DAPI, qui s’intercale avec l’ADN, et sans colorants de cellules vivantes qui sont toxiques à long terme pour les cellules.