
Compteur de cellules
Au compteur de cellules : Cellules U937
Des cellules U937 ont été isolées à partir d’un lymphome histiocytaire d'un patient âgé de 37 ans en 1974. Comme elles font partie des quelques lignées cellulaires disponibles exprimant de nombreuses caractéristiques monocytaires, elles sont souvent utilisées pour étudier le comportement et la différenciation des monocytes. Les cellules U937 subissent l’apoptose lorsqu’elles sont traitées avec un facteur de stimulation des colonies de granulocytes-macrophages (GM-CSF; Okuma et al., 2000), ce qui fait d’elles un modèle utile pour étudier la signalisation cellulaire apoptotique.
Visionner le webinaire StainFree Cell Detection
Télécharger la note d’application StainFree Cell Detection
Télécharger le livre électronique : comptez les cellules comme un-e pro
Figure 1 : Images obtenues avec le cytomètre SpectraMax MiniMax

Des cellules U937 ont été identifiées avec le paramétrage d’analyse prédéfini « CellsC » dans le logiciel SoftMax Pro. À gauche, image par lumière transmise ; à droite, analyse StainFree avec masques violets indiquant les cellules identifiées par le logiciel.
Figure 2 : Numérations cellulaires StainFree vs. numérations cellulaires par fluorescence
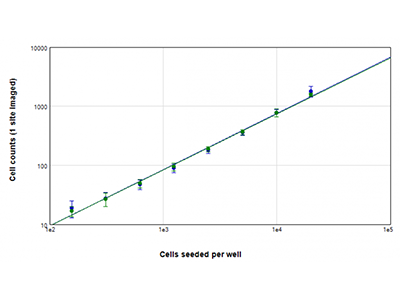
Des cellules U937 ont été ensemencées à des densités comprises entre 156 et 20 000 cellules par puits, et les noyaux ont été colorés avec le colorant vert EarlyTox™ Live. Les images ont été acquises à partir d'un site par puits. Les cellules sur chaque image ont ensuite été comptées par la méthode StainFree (tracé bleu) ou par numération des noyaux fluorescents verts (tracé vert).
Figure 3 : essai EarlyTox Live/Dead
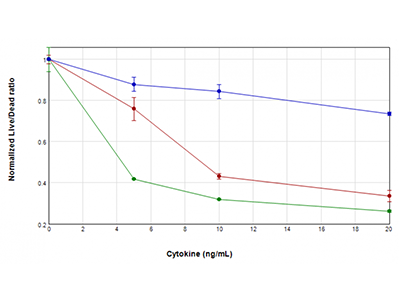
Les cellules U937 ont été traitées avec des concentrations de GM-CSF (tracé bleu), TNFα (tracé rouge) ou TNFα plus GM-CSF (tracé vert) comprises entre 0 ng/ml et 20 ng/ml, pendant 48 heures. Leur viabilité a ensuite été testée avec le kit de test EarlyTox™ Live/Dead. La fluorescence a été détectée avec le lecteur de microplaques multimode SpectraMax i3x. On a tracé le rapport du signal fluorescent vivantes/mortes vs la concentration en cytokine, révélant une perte de la viabilité cellulaire dans les cellules traitées qui est particulièrement sévère lorsque le TNFα et le GM-CSF sont associés.
Figure 4 : Essai EarlyTox Caspase-3/7 R110
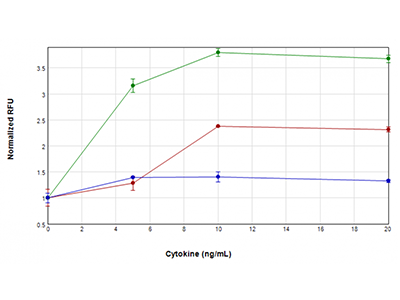
Des cellules U937 ont été traitées avec des concentrations de TNFα plus GM-CSF (tracé vert), TNFα (tracé rouge) ou GM-CSF uniquement (tracé bleu) comprises entre 0 ng/ml et 20 ng/ml, pendant 48 heures. Leur activité caspase-3/7 a ensuite été testée avec l'essai EarlyTox™ Caspase-3/7 R110. Un signal fluorescent indiquant une activité de la caspase a été détecté avec le lecteur SpectraMax i3x. L’activité la plus élevée de la caspase a été observée lorsque les cellules étaient traitées avec du TNFα et du GM-CSF, suggérant une activation synergique de la caspase.
Figure 5 : Essai EarlyTox Caspase-3/7 NucView 488
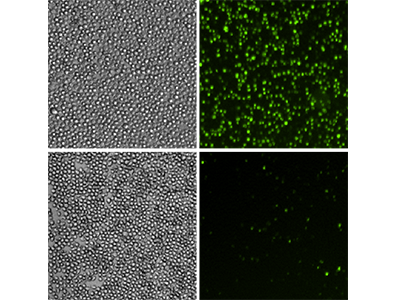
Des cellules U937 ont été traitées avec 10 ng/ml de TNFα et de GM-CSF (ligne du haut) ou laissées non traitées (ligne du bas) pendant 48 heures. Elles ont ensuite été analysées avec l'essai EarlyTox™ Caspase-3/7 NucView™ 488. Une coloration fluorescente verte a identifié les cellules ayant une activité caspase-3/7. Panneaux de gauche, images des cellules par lumière transmise ; panneaux de droite, images par fluorescence verte révélant les cellules présentant une activité caspase-3/7.
Astuce :
Les cellules U937 se développent en suspension et ont une forme arrondie qui les rend faciles à compter. Pour la numération StainFree, il suffit d’utiliser le paramétrage d’analyse prédéfini « CellsC » dans le menu déroulant du logiciel SoftMax Pro pour analyser en un clic les images des cellules.
Kit d’outils d’analyse des cellules U937
- Plateforme de détection de microplaques multimode SpectraMax® i3
- Cytomètre d’imagerie SpectraMax®MiniMax™ 300
- Logiciel SoftMax ® Pro Software
Lumière transmise (TL)
541 nm (fluorescence verte)
Exposition à la TL : 7 ms
Réglage de la mise au point de la TL : 5 µm
Exposition 541 : 1 ms
Réglage de la mise au point de la 541 : 40 µm
Type d’analyse : Analyse d'objets discrets
Longueur d’onde pour trouver des objets : TL (StainFree) ou 541 (noyaux verts)
TL : CellsC (prédéfini)
541 : Définir la taille et l’intensité : Taille = 10-30 µm, Intensité au-dessus du bruit de fond = 150
À propos de la technologie StainFree Cell Detection
Les essais d’imagerie cellulaires nécessitent généralement l'utilisation de sondes fluorescentes pouvant se révéler toxiques pour les cellules vivantes ou ne peuvent être utilisées que dans des cellules fixées. Une méthode sans marquage pour analyser les numérations cellulaires et la confluence des cellules vous permet de surveiller quantitativement la prolifération et la santé des cellules sans flux de travail fastidieux pouvant perturber la viabilité cellulaire.
La plateforme de microplaques multimode SpectraMax i3/i3x avec le cytomètre d’imagerie MiniMax 300 utilise la technologie unique StainFree Cell Detection en attente de brevet, qui vous permet de réaliser des essais de prolifération cellulaire, de cytotoxicité et d’autres essais sans colorations nucléaires tels que DAPI, qui s’intercale à l’ADN, ni colorants de cellules vivantes qui sont toxiques à long terme pour les cellules.