
Accélération de la production d’anticorps monoclonaux pour le traitement du SARS-CoV-2
Grâce aux solutions de Molecular Devices, les chercheurs peuvent accélérer le processus d’approbation de la FDA et accélérer la découverte d’anticorps monoclonaux
Le délai d’identification et de développement d’anticorps neutralisants efficaces d’un point de vue clinique contre les particules virales du laboratoire au patient est généralement 18 de à 24 mois. La course mondiale à l’identification d’anticorps neutralisants efficaces contre la protéine spike du virus SARS-CoV-2 est devenue une question de vie et de mort alors que le nombre de morts dans le monde a augmenté au cours de la première année de la pandémie de COVID-19.
En utilisant une combinaison d’instruments CloneSelect de Molecular Devices, avec l’imprimante CloneSelectκ Single-Cell Printerκ et l’imageur CloneSelect Imager , le délai de développement préclinique d’anticorps neutralisants efficaces peut être considérablement raccourci. En fait, la vitesse à laquelle le monde pharmaceutique a pu créer et déployer des anticorps monoclonaux anti-SARS-CoV-2 témoigne de la puissance et de la promesse de l’automatisation du développement de lignées cellulaires.
Dans cet article, nous démontrons les étapes du développement d’anticorps monoclonaux avec les instruments Molecular Devices, de la sélection clonale au suivi de la croissance cellulaire en passant par l’assurance de monoclonalité basée sur l’image. Un rapport de monoclonalité basé sur image est ensuite généré pour être inclus dans les applications de licence mondiales telles que la Biologics License Application (BLA) à la Food and Drug Administration (FDA) des États-Unis.
Anticorps monoclonaux comme alternative à la thérapie par convalescence plasmatique
Plus récemment, des anticorps monoclonaux, des anticorps de laboratoire clonés à partir de globules blancs, sont disponibles pour le traitement du virus SARS-CoV-2 . Le terme monoclonal décrit une lignée cellulaire provenant d’un seul progéniteur (cellule unique) et la documentation de preuves de clonalité est nécessaire pour le dépôt réglementaire. Les résultats préliminaires ont montré que ces anticorps fournissent un support immunologique pendant au moins 5à7 mois [ 5]. Compte tenu du potentiel thérapeutique, la production rapide et efficace d’anticorps monoclonaux est devenue de plus en plus cruciale.
Il y a un problème avec les anticorps monoclonaux : le délai entre la découverte et les essais de validation de principe. Le délai entre l’identification de l’anticorps et l’essai de phase I IND peut prendre jusqu’à 10à12 mois [ 6]. Toutefois, grâce à la transfection, la sélection et le criblage de clones rapides et efficaces, il existe des moyens d’accélérer le procédé et de réduire de moitié le calendrier de production.
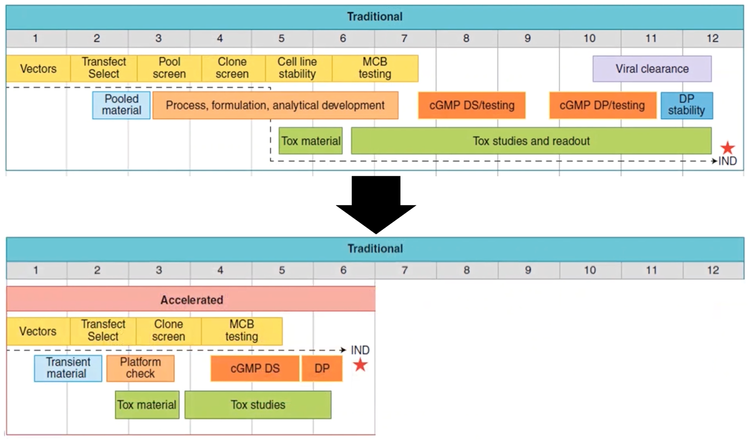
Figure 2 -Le délai entre la découverte et les essais de validation de principe pourrait être réduit à 5à6 mois par rapport à un calendrier traditionnel de 10à12 mois.
Flux de travail accéléré de développement d’anticorps monoclonaux
Comme les réglementations relatives au développement de lignées cellulaires sont de plus en plus strictes, les chercheurs devront réaliser un clonage de cellules uniques et fournir des preuves qu’une lignée cellulaire est dérivée d’une cellule unique, preuve de clonalité. Les méthodes traditionnelles de clonage (par ex., dilution limitante et FACS) utilisent l’analyse statistique pour déterminer un niveau de confiance pour la monoclonalité. Toutefois, pour prouver la monoclonalité, il est nécessaire d’avoir des technologies et des méthodologies plus robustes dans le domaine des bioprocédés. De nombreux chercheurs utilisent désormais régulièrement des systèmes d’imagerie, tels que le CloneSelect Imager , pour vérifier la monoclonalité et surveiller la croissance cellulaire dans les milieux de culture cellulaire.
Un flux de travail de production idéal qui génère une assurance de monoclonalité acceptable se compose des étapes suivantes.
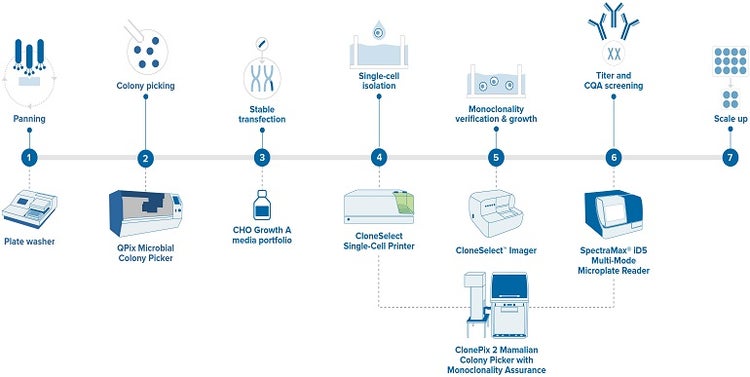
Figure 3 -Flux de travail de développement d’anticorps monoclonaux
Défi 1 : Isolement des cellules uniques
La clé d’une production robuste d’anticorps monoclonaux est d’isoler des cellules individuelles hautement performantes. Cependant, il existe divers défis pour l’isolation des cellules uniques, tels que l’obtention d’un nombre suffisant de cellules cibles et le maintien de la viabilité cellulaire.
La dilution limitante (LD) est une méthode d’isolation traditionnelle, dans laquelle la culture cellulaire parente subit une série de dilutions jusqu’à ce qu’il y ait une cellule par plaque dans un puits sur la base des calculs de probabilité. Le principal inconvénient provient de sa faible efficacité d’isolation, ce qui signifie que le nombre de cellules par plaque fluctue entre zéro et plusieurs cellules [ 7].
La cytométrie en flux (FC) est une méthode d’isolation plus efficace qui met en œuvre le tri cellulaire activé par fluorescence, mais elle compromet la viabilité cellulaire, en raison de la haute pression, de l’exposition à la charge électrique et des collisions fréquentes à haute vitesse. Les conditions non viables conduisent à ce que l’on appelle le stress cellulaire induit par le trieur (SICS) [ 8]. Donc, si vous travaillez avec des types de cellules sensibles, la lignée cellulaire obtenue à partir de la cytométrie en flux peut ne pas être adaptée à des recherches ultérieures et fixer votre calendrier à plusieurs mois.
La microfluidique , le processus d’isolation des cellules uniques dans les puces microfluidiques, est devenue une alternative plus efficace aux méthodes conventionnelles. L’un des facteurs qui distinguent la microfluidique est la réduction massive des volumes d’entrée, car vous chargez vos échantillons dans des puces de microlitres. Comme les micropuces ont une pression de tri plus faible, le risque de SICS est également réduit. Enfin, la microfluidique élimine le risque de contamination d’un échantillon à l’autre [ 9].
Nous avons récemment comparé l’efficacité des cellules uniques de ces trois méthodes. Pour la démonstration de l’isolation basée sur la microfluidique, nous avons utilisé notre imprimante CloneSelect Single-Cell Printer qui associe la technologie à l’imagerie haute résolution pour isoler des cellules individuelles tout en enregistrant des preuves de monoclonalité basées sur des images. Comme vous pouvez le constater dans le graphique à barres ci-dessous, l’imprimante CloneSelect Single-Cell Printer a surpassé la LD et la FC de 8 fois et 10-20 %, respectivement.
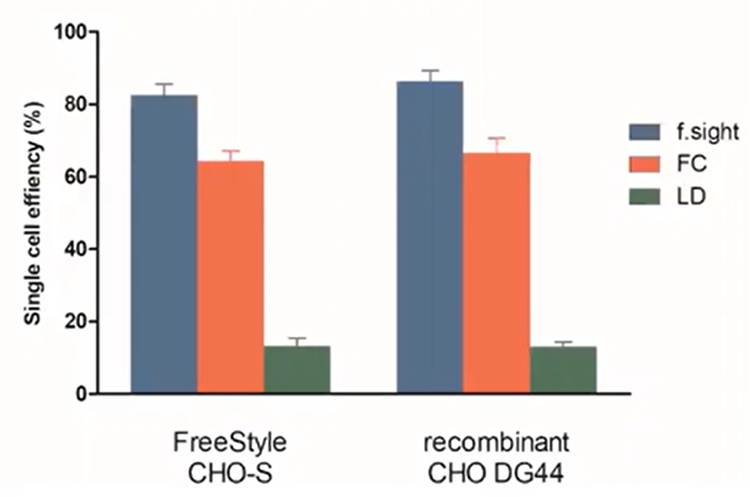
Figure 4 -Efficacité d’une cellule unique : Le f-sight a une efficacité de placage supérieure à celle de la LD et de la FC.
Défi 2 : Efficacité de l’excroissance des colonies
La question suivante est la suivante : Comment l’efficacité des cellules uniques se traduit-elle lorsque vous essayez de générer des colonies monoclonales ?
Pour la comparaison de l’excroissance coloniale de la microfluidique à la LD et à la FC, nous avons utilisé le CloneSelect Imager , qui nous a permis de scanner la division à partir d’une cellule unique pendant 90 secondes. Le CloneSelect Imager a fourni à la fois des statistiques graphiques et des miniatures visuelles de la croissance cellulaire comme preuve. Étant donné que le CSI permet une numérisation ultérieure de la plaque pendant 14 jours, vous pouvez facilement remonter de l’image finale au jour zéro pour prouver que la colonie s’est effectivement formée à partir d’une cellule unique. En outre, vous pouvez exporter vos images de colonies sous forme de rapport PDF ou Word pour l’assurance de monoclonalité basée sur l’image.
Alors, comment cela contribue-t-il à réduire le calendrier ? Au lieu d’une isolation en deux temps pour fournir une assurance basée sur la probabilité et l’image, vous pouvez utiliser une imprimante à cellule unique et un imageur en synergie pour un cycle de clonage. Il a été prouvé que cette méthode confère une assurance de monoclonalité avec plus de 99,99 % de confiance [ 10].
Les résultats d’efficacité de l’excroissance sont représentés ci-dessous pour les cellules CHO de type libre et recombinantes .
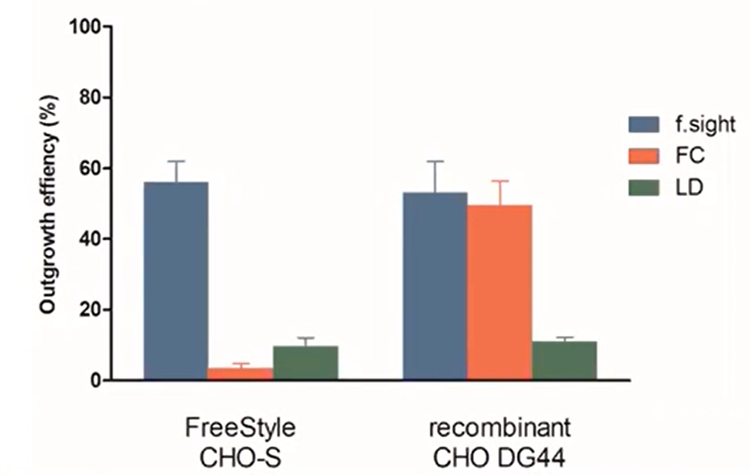
Figure 5 -Efficacité de l’excroissance coloniale : La f.sight montre une amélioration de l’excroissance clonale cinq fois plus importante que la dilution limite traditionnelle.
Comme pour l’efficacité des cellules uniques, la LD a obtenu de mauvais résultats pour les deux lignées cellulaires. Il est intéressant de noter que la FC a montré une efficacité presque égale à celle de l’imprimante CloneSelect Single-Cell Printer dans les cellules recombinantes, mais 15 fois moins bonne dans les cellules de type libre. Cela indique clairement que l’imprimante CloneSelect Single-Cell Printerκ, associée à la technologie CloneSelect® Imager, est plus homogène en termes d’excroissance colique que la CF.
Défi 3 : Monoclonalité et sécrétion à grande échelle
L’isolation de clones de cellules de mammifères candidats peut être laborieuse et fastidieuse, car vous devez cribler des centaines de milliers de clones non seulement pour la monoclonalité, mais aussi pour la sécrétion suffisante d’anticorps.
Molecular Devices a développé le système ClonePix® pour un flux de travail de développement de lignées cellulaires automatisé de bout en bout avec preuve de monoclonalité. Le système ClonePix est équipé pour cribler et quantifier les anticorps neutralisants sécrétés par un grand nombre de clones CHO in situ . Le logiciel utilise une sonde de détection fluorescente pour quantifier la sécrétion et sélectionne automatiquement les clones avec le rendement le plus élevé.
Comme illustré ci-dessous, le ClonePix® surpasse la LD dans plusieurs aspects. Non seulement il peut cribler un nombre significativement plus important de colonies en utilisant moins de plaques, mais il sélectionne également des colonies ayant des rendements plus élevés.
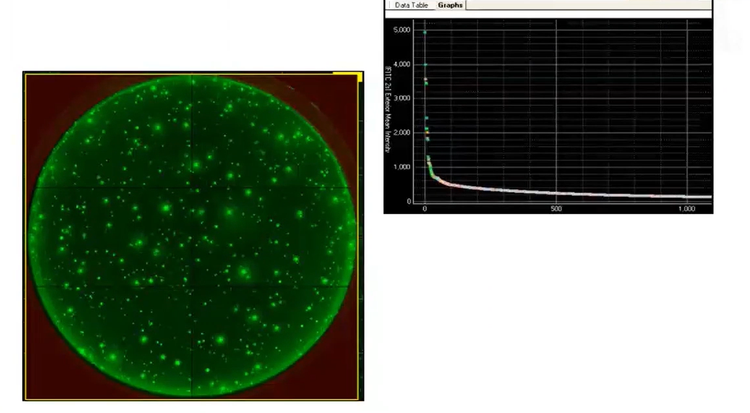
Figure 6 -ClonePix : in situ permet une date cumulée plutôt qu’un point temporel unique pour déterminer la productivité.
Qu’en est-il de la réduction des délais ? La version originale du système de repiquage de colonies de cellules de mammifères ClonePix2 nécessite deux séries de criblage, comme suggéré par la FDA, de concert avec la combinaison CloneSelect Single-Cell Printer et Imager.
Découvrez les flux de travail prêts pour l’automatisation de laboratoire
Faisons de vos idées une réalité ! Notre équipe de personnalisation et d’automatisation a réussi à personnaliser le système de sélection de colonies 2 de mammifères ClonePix pour les clients sur demande, y compris les logiciels et le matériel. Par exemple, en mettant à jour le système avec des capacités d’assurance monoclonale supplémentaires, un seul instrument peut répondre à tous les besoins de production d’anticorps monoclonaux, du criblage d’anticorps au titre avec une série de criblage de clones.
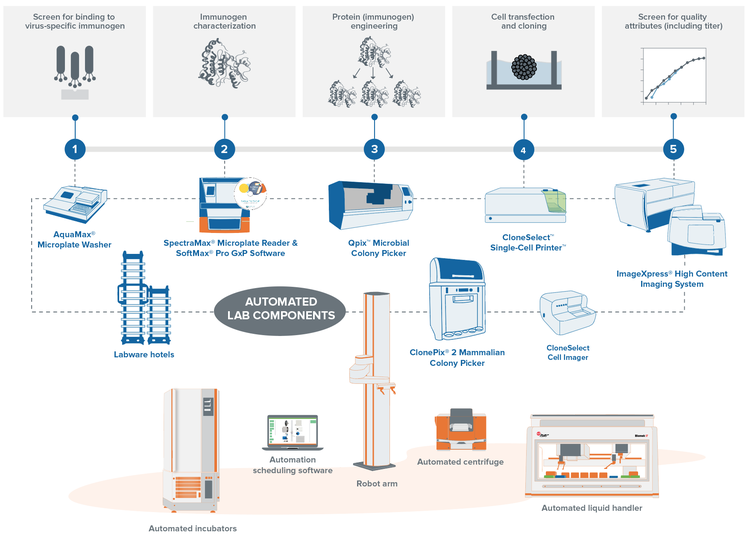
Grâce aux flux de travail automatisés de criblage de clones de Molecular Devices, vous pouvez alléger la charge de travail de votre laboratoire en réduisant considérablement le temps de manipulation tout en créant un référentiel central pour les données extraites de plusieurs processus. Nos solutions automatisées unifient tous les appareils de laboratoire pour augmenter votre débit et votre efficacité tout en réduisant l’intervention humaine.
Webinaire à la demande : Flux de travail optimal pour identifier rapidement les anticorps neutralisants dirigés contre les particules virales
Pour en savoir plus sur le flux de travail des anticorps neutralisants contre le SARS-CoV-2 et sur la manière dont Molecular Devices peut l’optimiser, vous pouvez regarder notre webinaire gratuitprésenté par Rebecca Kreipke, Ph.D., Chercheur en applications sur le terrain BiPharma.
Inscrivez-vous dès aujourd’hui
Références
- Mair-Jenkins, John, et al. « L’efficacité du plasma de convalescence et de l’immunoglobuline hyperimmune dans le traitement des infections respiratoires aiguës graves d’étiologie virale : une revue systématique et une méta-analyse exploratoire. » The Journal of infectious diseases 211,1 ( 2015) : 80-90.Mair-Jenkins, John, et al. « L’efficacité du plasma de convalescence et de l’immunoglobuline hyperimmune pour le traitement des infections respiratoires aiguës sévères d’étiologie virale : une revue systématique et une méta-analyse exploratoire. » The Journal of infectious diseases 211,1 (2015) : 80-90.
- Ko, Jae-Hoon, et al. « Difficultés du traitement par perfusion de plasma convalescent dans l’infection par le coronavirus respiratoire du Moyen-Orient : une expérience unique. » Antivir ( 23,7 2018) : 617-622.Ko, Jae-Hoon, et al. « Difficultés du traitement par perfusion de plasma convalescent dans l’infection à coronavirus respiratoire du Moyen-Orient : une expérience dans un seul centre. » Antivir (23,72018) : 617-622.
- Shen, Chenguang, et al. « Traitement de patients 5 gravement malades atteints de COVID-19 avec plasma de convalescence. » Jama 323,16 ( 2020) : 1582-1589.Shen, Chenguang, et al. « Traitement de patients 5 gravement malades atteints de COVID-19 avec plasma de convalescence. » Jama 323,16 (2020) : 1582-1589.
- Gontu, Abhinay, et al. « Fenêtre limitée pour le don de plasma de convalescence avec des titres élevés d’anticorps neutralisants du virus vivant pour l’immunothérapie contre la COVID-19. » Biologie des communications 4,1 ( 2021) : 1-9.Gontu, Abhinay, et al. « Fenêtre limitée pour le don de plasma de convalescence avec des titres élevés d’anticorps neutralisants du virus vivant pour l’immunothérapie contre la COVID-19. » Biologie des communications 4,1 (2021) : 1-9.
- Ripperger, Tyler J., et al. « Les tests sérologiques orthogonaux du SARS-CoV-2 permettent la surveillance des communautés à faible prévalence et révèlent une immunité humorale durable. » Immunité 53,5 ( 2020) : 925-933.Ripperger, Tyler J., et al. « Les tests sérologiques orthogonaux du SARS-CoV-2 permettent la surveillance des communautés à faible prévalence et révèlent une immunité humorale durable. » Immunité 53,5 (2020) : 925-933.
- Kelley, Brian. « Développement d’anticorps monoclonaux thérapeutiques au rythme de la pandémie. » Biotechnologie naturelle 38,5 ( 2020) : 540-545.Kelley, Brian. « Développement d’anticorps monoclonaux thérapeutiques au rythme de la pandémie. » Biotechnologie de la nature 38,5 (2020) : 540-545.
- Heisler, E., et H. W. Vohr. « Modèles 3D peau humaine/épidermique et systèmes organotypiques explantant la peau humaine et murine. La référence encyclopédique de l’immunotoxicologie. » (2005).Heisler, E., et H. W. Vohr. « Modèles 3D peau humaine/épidermique et systèmes organotypiques explantant la peau humaine et murine. La référence encyclopédique de l’immunotoxicologie. » (2005).
- Hu, Ping, et al. « Isolation et analyse de cellules uniques. » Frontières en biologie cellulaire et développementale 4 ( 2016) : 116.Hu, Ping, et al. « Isolation et analyse de cellules uniques. » Frontières en biologie cellulaire et développementale 4 (2016) : 116.
- Gross, Andre, et al. « Technologies d’isolation des cellules uniques. » Journal international des sciences moléculaires 16,8 ( 2015) : 16897-16919.Gross, Andre, et al. « Technologies d’isolation des cellules uniques. » Journal international des sciences moléculaires 16,8 (2015) : 16897-16919.
- Yim, Mandy et David Shaw. « Obtenir une plus grande efficacité et une plus grande confiance dans le clonage des cellules uniques en combinant les technologies d’impression cellulaire et d’imagerie sur plaque. » Progrès en biotechnologie 34,6 ( 2018) : 1454-1459.Yim, Mandy et David Shaw. « Obtenir une plus grande efficacité et une plus grande confiance dans le clonage de cellules uniques en combinant les technologies d’impression cellulaire et d’imagerie sur plaque. » Progression des biotechnologies 34,6 (2018) : 1454-1459.
