
Fluorescence
Qu’est-ce que la fluorescence ?
La fluorescence est la propriété de certains atomes et molécules qui leur permet d’absorber la lumière à une longueur d'onde particulière (excitation : Ex) suivie d’une brève émission (Em) de lumière à une longueur d’onde plus longue (Figure 2). La distance entre les pics d’excitation et d’émission est appelée déplacement de Stokes (ou Stokes shift) et dépend du fluorophore (Figure 1).
La fluorescence implique une source de lumière externe pour exciter l’échantillon à une longueur d'onde particulière. Lorsque la molécule est excitée à la longueur d'onde appropriée, elle passe d’un état fondamental à un état excité. Lorsque la molécule retourne à l’état fondamental, de l’énergie est libérée sous forme de chaleur (perte d’énergie) et de lumière à une longueur d’onde plus longue et différente de celle d’énergie plus faible (Figure 3).
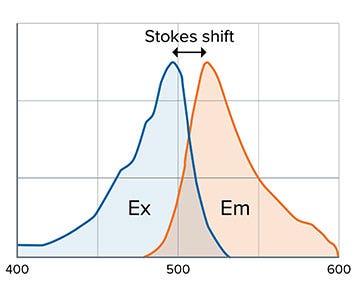
Figure 1
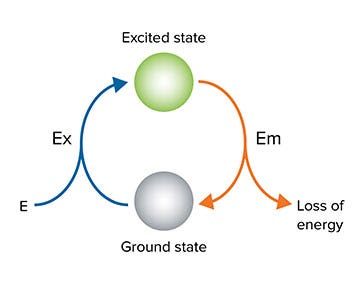
Figure 2
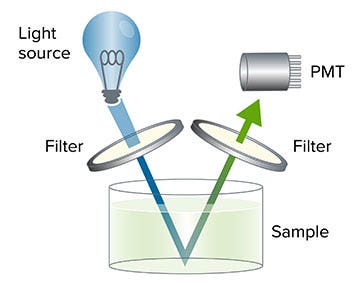
Figure 3
Comment fonctionne la détection de la fluorescence ?
Un lecteur de microplaques avec détection de l’intensité de la fluorescence (IF) utilise une source de lumière, généralement une lampe flash Xenon ou une LED, pour exciter un fluorophore (molécule fluorescente) à une longueur d'onde particulière. La longueur d’onde requise pour exciter l’échantillon peut être sélectionnée en utilisant un filtre d’une longueur d’onde spécifique ou un monochromateur réglé à la longueur d’onde requise.
Le fluorophore émet alors une lumière d’une longueur d'onde différente, sélectionnée par un second filtre ou monochromateur. La fluorescence émise est détectée par un tube photomultiplicateur (TPM), et l’intensité de la fluorescence de l’échantillon est exprimée en unités de fluorescence relative.