
Compteur de cellules
Au compteur de cellules : Cellules CHO
Les cellules ovariennes de hamster chinois (CHO) sont une lignée cellulaire semblable aux cellules épithéliales couramment utilisées dans la recherche biologique et médicale. Développées il y a plus de 50 ans, elles sont utilisées dans d’innombrables études, allant de la génétique à la cytotoxicité. Elles sont particulièrement adaptées à la transfection et sont devenues la lignée cellulaire la plus populaire pour la fabrication des protéines recombinantes, notamment les thérapeutiques.
Visionner le webinaire StainFree Cell Detection
Télécharger la note d’application StainFree Cell Detection
Télécharger le livre électronique : comptez les cellules comme un-e pro
Figure 1 - Analyse StainFree de cellules CHO grâce au logiciel SoftMax Pro
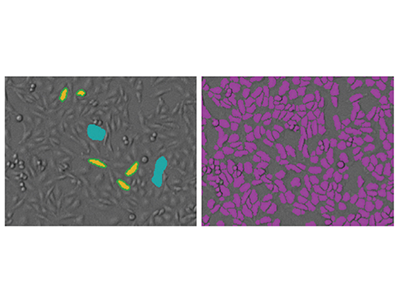
Sur ces images, les cellules CHO ont été étalées à raison de 4000 cellules par puits dans une microplaque à 384 puits. À gauche : Afin de créer un nouveau paramètre d’analyse StainFree, la souris est utilisée pour «dessiner» sur l’image, en indiquant les cellules individuelles (en jaune) et les zones sans cellules (en bleu). À droite : les masques violets montrent les objets identifiés par le logiciel dans l’image. Sinon, un paramètre d’analyse d’images prédéfini peut être utilisé pour une analyse en un clic des numérations de cellules CHO.
Figure 2. Technologie StainFree comparée à la numération cellulaire par fluorescence
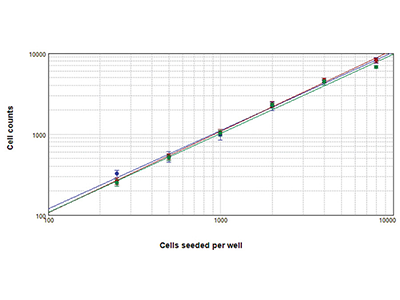
Cellules comptées au moyen de la technologie StainFree™ Cell Detection (bleu), de la coloration nucléaire rouge (rouge) et de la coloration verte des cellules entières (vert). Les numérations obtenues avec ces trois méthodes sont très semblables, démontrant que la technologie StainFree donne des numérations cellulaires précises tout en éliminant le besoin de recourir à des colorants fluorescents (r > 0,99 pour chaque tracé).
Figure 3 - Confluence des cellules
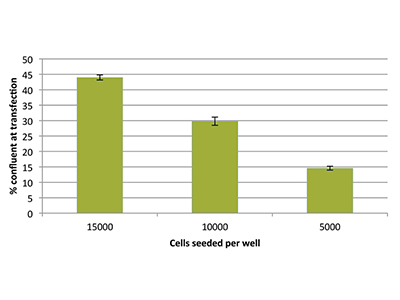
La confluence des cellules en pourcentage juste avant la transfection a été déterminée en utilisant la technologie StainFree. Pour des densités d’ensemencement initiales de 15000, 10000 et 5000 cellules par puits, la confluence en pourcentage mesurée après une croissance pendant la nuit était respectivement de 44, 30 et 15.
Figure 4 - Imagerie des cellules transfectées avec la GFP
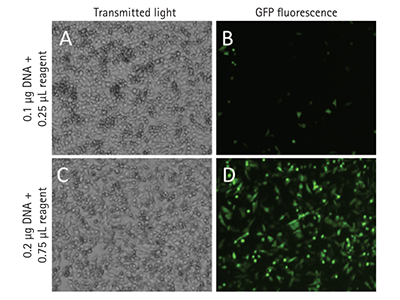
Les cellules transfectées ont été imagées en utilisant les canaux TL (A, C) et fluorescents verts (B, D) du cytomètre d’imagerie SpectraMax MiniMax 300. Les cellules illustrées ont été ensemencées à raison de 15000 cellules par puits dans une microplaque à 96 puits. Deux conditions de transfection sont présentées, représentant les efficacités de transfection faible (B) et élevée (D). La technologie StainFree a été utilisée pour identifier les cellules individuelles, qui ont pu ensuite être classées comme positives ou négatives pour l’expression de la GFP.
Astuce 1 :
Pour compter les cellules CHO sans coloration, j’utilise le paramètre prédéfini « Cellules A » dans le logiciel SoftMax Pro. Cela fonctionne très bien sur les cellules CHO qui sont confluentes quelque soit l'endroit entre 5 et 95 %. Nous avons pu obtenir une excellente corrélation entre les numérations StainFree et les numérations nucléaires fluorescentes à partir d'exactement les mêmes échantillons. (Voir Fig. 2 et 3).
Astuce 2 :
Obtenir des numérations StainFree plus précises. Lors de l’imagerie dans le canal TL, plutôt que d’utiliser une hauteur de réglage de mise au point donnant l’image la plus nette possible, essayez de baisser le réglage de la mise au point sur une position un peu plus négative, par exemple, de 0 à -20. L’objectif est d’avoir sur votre image des cellules dont le centre est lumineux et les bords sombres. Cela vous permettra de gagner beaucoup de temps et d’obtenir de meilleurs résultats avec les paramètres d’analyse prédéfinis.
Kit d’outils d’analyse des cellules CHO
- Plateforme de détection de microplaques multimode SpectraMax® i3
- Cytomètre d'imagerie SpectraMax® MiniMax™ 300
- Logiciel SoftMax® Pro
Paramétrages de l’instrument
À propos de la technologie StainFree Cell Detection
Les essais d’imagerie cellulaires nécessitent généralement l'utilisation de sondes fluorescentes pouvant se révéler toxiques pour les cellules vivantes ou ne peuvent être utilisées que dans des cellules fixées. Une méthode sans marquage pour analyser les numérations cellulaires et la confluence des cellules vous permet de surveiller quantitativement la prolifération et la santé des cellules sans flux de travail fastidieux pouvant perturber la viabilité cellulaire.
La plateforme de microplaques multimode SpectraMax i3 avec le cytomètre d’imagerie MiniMax 300 utilise la technologie unique StainFree Cell Detection en attente de brevet, qui vous permet de réaliser des essais de prolifération cellulaire, de cytotoxicité et d’autres essais sans colorations nucléaires tels que DAPI, qui s’intercale avec l’ADN, et sans colorants de cellules vivantes qui sont toxiques à long terme pour les cellules.