
Compteur de cellules
Au compteur de cellules : Cellules HeLa
Les cellules HeLa sont la première lignée cellulaire à être cultivée en laboratoire et sont encore utilisées aujourd'hui dans d'innombrables projets de recherche biomédicale. Elles proviennent de cellules de cancer du col de l’utérus prélevées en 1951 chez Henrietta Lacks, une patiente qui a par la suite succombé à sa maladie. Le best-seller de Rebecca Skloot « The Immortal Life of Henrietta Lacks » (La vie immortelle d’Henrietta Lacks) raconte l’histoire fascinante de sa vie et de son héritage.
Visionner le webinaire StainFree Cell Detection
Télécharger la note d’application StainFree Cell Detection
Télécharger le livre électronique : comptez les cellules comme un-e pro
Figure 1. Analyse StainFree comparée à la numération cellulaire par fluorescence
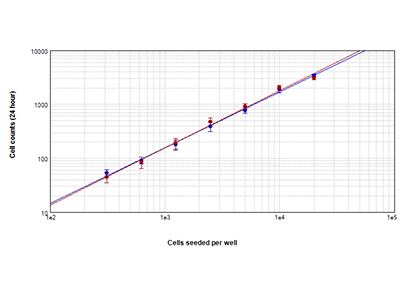
Cellules HeLa comptées grâce à la technologie StainFree™ Cell Detection (cercles bleus) et de la coloration nucléaire rouge (cercles rouges). Les numérations obtenues avec ces deux méthodes sont très semblables, démontrant que la technologie StainFree donne des numérations cellulaires précises tout en éliminant la nécessité de recourir aux colorants fluorescents (r > 0,99 pour chaque tracé).
Figure 2 - Les courbes de croissance obtenues avec StainFree ont couvert l’analyse de la zone
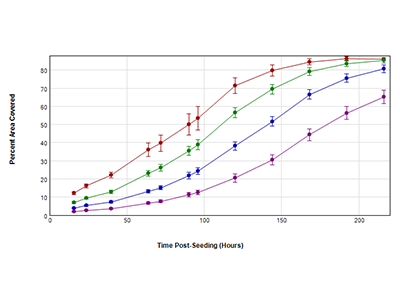
Des cellules HeLa ont été ensemencées avec 4 densités initiales dans une microplaque à 96 puits : 250 cellules (violet), 500 cellules (bleu), 1000 cellules (vert) et 2000 cellules (rouge) par puits. Les cellules ont été imagées avec le canal de lumière transmise (TL) pendant 9 jours. La zone couverte par les cellules en pourcentage à chaque point dans le temps a été déterminée par analyse StainFree.
Figure 3 - Cytotoxicité mesurée avec la technologie StainFree
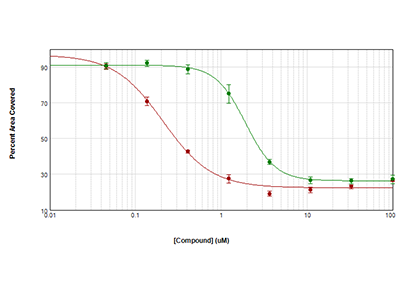
Les cellules HeLa ont été ensemencées à raison de 1000 cellules par puits et ont été laissées en culture pendant toute la nuit. Elles ont ensuite été traitées avec de l’anisomycine (cercles rouges) ou de la trichostatine (cercles verts) pendant 72 heures. La cytotoxicité a été mesurée en calculant la zone couverte en pourcentage en utilisant l’analyse StainFree. Les courbes de CI50 ont été tracées avec le logiciel SoftMax Pro.
Figure 4 - Images de cellules HeLa traitées avec des composés toxiques

Ligne du haut : Des cellules HeLa ont été traitées avec une dose faible (à gauche) ou une dose élevée (à droite) d’anisomycine et images avec le canal de lumière transmise (TL). Ligne du bas : Des cellules HeLa ont été traitées avec des concentrations faible (à gauche) ou élevée (à droite) de staurosporine et ont été testées concernant la cytotoxicité avec le kit d'intégrité cellulaire EarlyTox. Les cellules vivantes sont marquées en rouge et les cellules mortes sont marquées à la fois en rouge et vert.
Astuce 1 :
Pour compter les cellules HeLa sans coloration, utilisez le paramétrage prédéfini « CellsA » dans le logiciel SoftMax Pro ou créez un nouveau paramétrage à l’aide des outils de dessin du logiciel. La méthode d’analyse utilisée dépend de la morphologie et des conditions de développement de vos cellules. Essayez en premier le paramétrage prédéfini et voyez ce que ça donne.
Astuce 2 :
L’obtention de courbes de croissance comme celles illustrées ici est simplifiée avec la fonction Analyse de champ du logiciel SoftMax Pro. L’analyse de champ calcule la zone couverte par les cellules en pourcentage (confluence) sur les images. Il peut également être utile de calculer la confluence des cellules pour le développement d'essais. Vous pouvez par exemple tester vos cellules à plusieurs densités différentes et déterminer laquelle permet d’obtenir les meilleurs résultats.
Astuce 3 :
Il est facile de surveiller la cytotoxicité dans le temps. Il suffit d’analyser la zone couverte par les cellules en pourcentage aux points souhaités dans le temps et de tracer les résultats dans le logiciel SoftMax Pro. Inutile de colorer ou de récolter vos cellules.
Kit d’outils d’analyse de cellules HeLa
- Plateforme de détection de microplaques multimode SpectraMax® i3
- Cytomètre d'imagerie SpectraMax® MiniMax™ 300
- Logiciel SoftMax® Pro
- Kit d’intégrité cellulaire EarlyTox™
Paramétrages de l’instrument
Type d’analyse : Analyse d'objets discrets
Longueur d’onde pour trouver des objets : TL
À propos de la technologie StainFree Cell Detection
Les essais d’imagerie cellulaires nécessitent généralement l'utilisation de sondes fluorescentes pouvant se révéler toxiques pour les cellules vivantes ou ne peuvent être utilisées que dans des cellules fixées. Une méthode sans marquage pour analyser les numérations cellulaires et la confluence des cellules vous permet de surveiller quantitativement la prolifération et la santé des cellules sans flux de travail fastidieux pouvant perturber la viabilité cellulaire.
La plateforme de microplaques multimode SpectraMax i3 avec le cytomètre d’imagerie MiniMax 300 utilise la technologie unique StainFree Cell Detection en attente de brevet, qui vous permet de réaliser des essais de prolifération cellulaire, de cytotoxicité et d’autres essais sans colorations nucléaires tels que DAPI, qui s’intercale avec l’ADN, et sans colorants de cellules vivantes qui sont toxiques à long terme pour les cellules.