
Compteur de cellules
Au compteur de cellules : Cellules Jurkat
Créées à la fin des années 1970 à partir du sang périphérique d’un jeune garçon atteint d’une leucémie à cellules T, les cellules Jurkat sont une lignée cellulaire immortalisée de lymphocytes T. Elles sont utilisées pour étudier la leucémie à cellules T, la signalisation des cellules T et la sensibilité des cellules cancéreuses aux traitements médicamenteux. Ces petites cellules rondes se développent facilement en suspension et ont également été utilisées comme système modèle pour divers essais sur l’apoptose et la viabilité cellulaire, tel que démontré ici.
Visionner le webinaire StainFree Cell Detection
Télécharger la note d’application StainFree Cell Detection
Télécharger le livre électronique : comptez les cellules comme un-e pro
Figure 1 : Numérations cellulaires StainFree

Des cellules Jurkat ont été imagées avec le cytomètre d’imagerie SpectraMax MiniMax 300, et les cellules ont été identifiées à l’aide du paramétrage prédéfini « CellsC ». À gauche se trouvent les images d'origine par lumière transmise, et à droite se trouvent les mêmes images avec des masques violets indiquant les cellules identifiées par le logiciel. Deux densités cellulaires sont illustrées : 50 000 et 1562 cellules ensemencées par puits d’une microplaque à 96 puits.
Figure 2 : Numérations cellulaires StainFree vs. numérations cellulaires par fluorescence
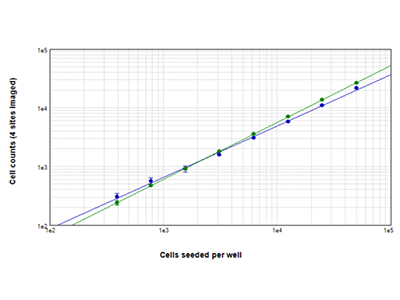
Des cellules Jurkat ensemencées à des densités comprises entre 390 et 50 000 cellules par puits ont été comptées avec la technologie StainFree (points bleus), ou les cellules ont été marquées avec le colorant pour essai EarlyTox™ Live Cell et les cellules fluorescentes vertes ont été comptées (points verts). Les numérations cellulaires obtenues avec les deux méthodes correspondaient étroitement dans toute la plage des densités cellulaires. Les numérations cellulaires ont été effectuées pour quatre sites imagés par puits.
Figure 3 : Essai EarlyTox™ Live/Dead
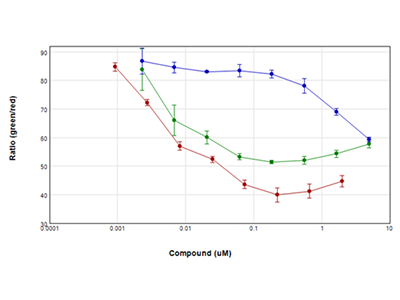
Les cellules Jurkat ont été traitées avec des dilutions en série de staurosporine (tracé rouge), de camptothécine (tracé vert) et d’étoposide (tracé bleu) pendant 24 heures, puis testées avec le kit pour essai EarlyTox Live/Dead de Molecular Devices. Les cellules vivantes ont été marquées avec de la calcéine AM (colorant vert) et les cellules mortes ont été marquées avec l’homodimère d'éthidium (colorant rouge) et lues sur un lecteur de microplaques multimode SpectraMax i3x en utilisant la fonction WellScan, qui exécute plusieurs lectures espacées régulièrement à travers le puits. Les résultats ont été tracés sous forme de rapport vert/rouge vs. concentration du composé. Tous les composés utilisés dans cette expérience ont provoqué une diminution considérable de la viabilité cellulaire en 24 heures.
Figure 4 : Essai EarlyTox Caspase-3/7 NucView™ 488
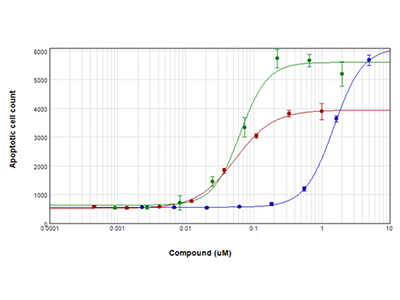
Les cellules Jurkat ont été traitées avec de la staurosporine (tracé rouge), de la camptothécine (tracé vert) ou de l’étoposide (tracé bleu) pendant 28 heures, puis testées concernant l'apoptose avec le kit pour essai EarlyTox Caspase-3/7 NucView 488. Les cellules exprimant la caspase-3/7 ont été colorées en vert fluorescent et ont été imagées et comptées avec le cytomètre SpectraMax MiniMax 300.
Astuce :
Grâce à leur morphologie arrondie et à leur taille uniforme, les cellules Jurkat sont assez faciles à imager et à compter. Pour la numération cellulaire StainFree, le paramètre prédéfini « CellsC » du logiciel SoftMax Pro Software fonctionne très bien.
Kit d’outils d’analyse des cellules Jurkat
- Plateforme de détection de microplaques multimode SpectraMax® i3x
- Cytomètre d’imagerie SpectraMax®MiniMax™ 300
- Logiciel SoftMax ® Pro Software
Type d’analyse : Analyse d'objets discrets
Longueur d’onde pour trouver des objets : TL
À propos de la technologie StainFree Cell Detection
Les essais d’imagerie cellulaires nécessitent généralement l'utilisation de sondes fluorescentes pouvant se révéler toxiques pour les cellules vivantes ou ne peuvent être utilisées que dans des cellules fixées. Une méthode sans marquage pour analyser les numérations cellulaires et la confluence des cellules vous permet de surveiller quantitativement la prolifération et la santé des cellules sans flux de travail fastidieux pouvant perturber la viabilité cellulaire.
La plateforme de microplaques multimode SpectraMax i3 avec le cytomètre d’imagerie MiniMax 300 utilise la technologie unique StainFree Cell Detection en attente de brevet, qui vous permet de réaliser des essais de prolifération cellulaire, de cytotoxicité et d’autres essais sans colorations nucléaires tels que DAPI, qui s’intercale avec l’ADN, et sans colorants de cellules vivantes qui sont toxiques à long terme pour les cellules.