
Compteur de cellules
Au compteur de cellules : Cellules MCF-7
Comme octobre est le mois de sensibilisation au cancer du sein, nous avons décidé de mettre en avant la lignée cellulaire de cancer du sein MCF-7. Dérivée en 1970 d’une nonne nommée Sœur Catherine Frances (Helen Marion) Mallon, cette lignée cellulaire tire son nom de la Michigan Cancer Foundation, où elle a été générée. MCF-7 est le nom des quelques lignées cellulaires de cancer du sein pour exprimer des niveaux significatifs du récepteur alpha des œstrogènes (ER), qui offre un système modèle précieux pour étudier les cancers du sein ER-positifs. Saisissez « cellules MCF-7 » dans PubMed et vous trouverez plus de 20 000 références à cette lignée cellulaire remarquable.
Visionner le webinaire StainFree Cell Detection
Télécharger la note d’application StainFree Cell Detection
Télécharger le livre électronique : comptez les cellules comme un-e pro
Figure 1 : Images obtenues avec le cytomètre SpectraMax MiniMax
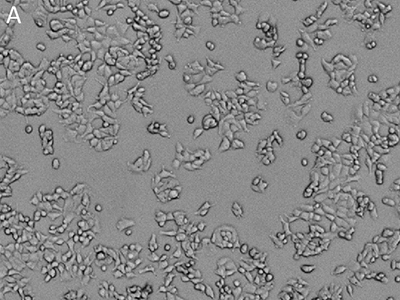
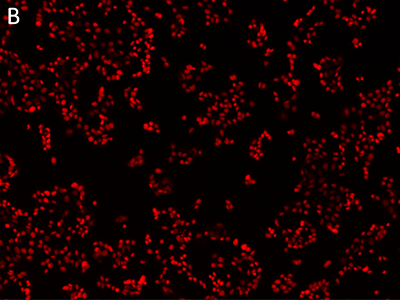

Les cellules MCF-7 ont été colorées avec le colorant rouge EarlyTox™ Live, puis évaluées par imagerie au moyen du cytomètre SpectraMax MiniMax. Les cellules ont été identifiées avec un paramètre personnalisé défini par l’utilisateur. A, image par lumière transmise ; B, noyaux marqués avec du colorant rouge EarlyTox Live ; C, cellules identifiées par analyse StainFree (les masques violets montrent les cellules identifiées par le logiciel).
Figure 2 : Numérations cellulaires StainFree vs. numérations cellulaires par fluorescence
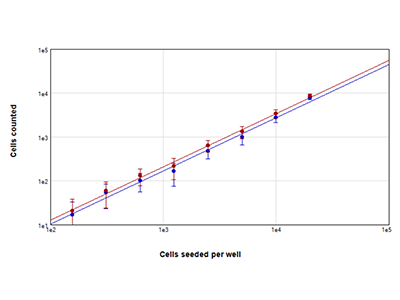
Les cellules MCF-7 ont été ensemencées à des densités comprises entre 156 et 20 000 cellules par puits, et les noyaux ont été colorés avec du colorant rouge EarlyTox Live. Les images ont été acquises à partir de 4 sites par puits, et une région d’intérêt au centre des puits a été sélectionnée pour analyse. Les cellules ont ensuite été comptées par la méthode StainFree (tracé bleu) ou en comptant les noyaux fluorescents rouges (tracé rouge).
Figure 3 : essai EarlyTox Live/Dead
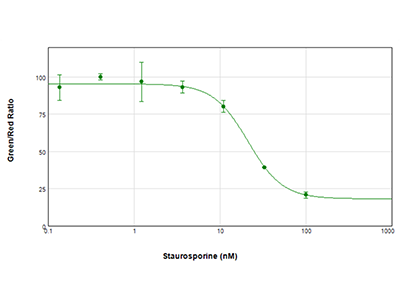
Les cellules MCF-7 ont été traitées avec des dilutions en série de staurosporine pendant 24 heures, puis testées avec le kit de test EarlyTox Live/Dead de Molecular Devices. Les cellules vivantes ont été marquées avec de la calcéine AM (colorant vert) et les cellules mortes ont été marquées avec un homodimère d'éthidium (colorant rouge). La plaque a été lue sur le lecteur de microplaques multimode SpectraMax i3x. Les résultats ont été tracés sous forme de rapport vert/rouge vs concentration du composé, et une valeur CI50 de 21,2 nM a été calculée avec le logiciel SoftMax Pro Software.
Astuce :
Les cellules MCF-7 ont une morphologie polygonale avec des dimensions irrégulières et elles ont l’habitude de s’amasser en de gros agrégats. Pour la numération cellulaire StainFree, utilisez « Créer un nouveau paramètre » et dessinez légèrement dans les limites des cellules en utilisant l’outil de dessin jaune. Utilisez l’outil de dessin bleu pour marquer les zones en dehors des limites des cellules. Sinon, vous pouvez utiliser le paramètre prédéfini « CellsC », mais il peut ne pas être assez précis.
Kit d’outils d’analyse des cellules MCF-7
- Plateforme de détection de microplaques multimode SpectraMax® i3x
- Cytomètre d’imagerie SpectraMax®MiniMax™ 300
- Logiciel SoftMax ® Pro Software
Lumière transmise (TL)
713 nm (fluorescence rouge)
Exposition à la TL : 7 ms
Réglage de la mise au point de la TL : 10 µm
Exposition 713 : 6 ms
Réglage de la mise au point de la 713 : 0 µm
Type d’analyse : Analyse d'objets discrets
Longueur d’onde pour trouver des objets : TL (StainFree) ou 713 (noyaux rouges)
À propos de la technologie StainFree Cell Detection
Les essais d’imagerie cellulaires nécessitent généralement l'utilisation de sondes fluorescentes pouvant se révéler toxiques pour les cellules vivantes ou ne peuvent être utilisées que dans des cellules fixées. Une méthode sans marquage pour analyser les numérations cellulaires et la confluence des cellules vous permet de surveiller quantitativement la prolifération et la santé des cellules sans flux de travail fastidieux pouvant perturber la viabilité cellulaire.
La plateforme de microplaques multimode SpectraMax i3 avec le cytomètre d’imagerie MiniMax 300 utilise la technologie unique StainFree Cell Detection en attente de brevet, qui vous permet de réaliser des essais de prolifération cellulaire, de cytotoxicité et d’autres essais sans colorations nucléaires tels que DAPI, qui s’intercale avec l’ADN, et sans colorants de cellules vivantes qui sont toxiques à long terme pour les cellules.