Histoire de la recherche sur les organoïdes : des cellules d’éponge aux organes fonctionnels
Commençons par une définition simple d’organoïde qui fait référence à un ensemble tridimensionnel qui contient plusieurs types de cellules disposés avec une histologie réaliste, au moins à l’échelle micrométrique. Les organoïdes peuvent se former à partir de cellules humaines ou animales, qui peuvent être des cellules différenciées, des cellules souches ou un mélange des deux.
L’utilisation croissante d’organoïdes est alimentée par le développement rapide de dérivés de cellules souches et la volonté de réduire l’utilisation de modèles animaux. Les organoïdes sont déjà utilisés pour comprendre les méthodes de développement de maladies, la néoplasie (cancer), ils sont utilisés dans des applications médicales et industrielles importantes (p. ex., toxicologie) et, en fin de compte, pour la transplantation. Kerry Grens, auteur au Scientist Magazine, a nommé les organoïdes comme l’un des « progrès de l’année ».1 Les organoïdes ont déjà été développés pour représenter de nombreuses parties différentes du corps humain, avec des applications qui devraient se développer au cours des prochaines années.

Historique de la recherche sur les organoïdes
Les organoïdes 3D sont indéniablement au centre de la modélisation des maladies et de la découverte de médicaments. Étant donné que ces cultures cellulaires s’auto-organisent en groupes et se différencient en types de cellules qui constituent un organe fonctionnel, elles sont bien meilleures pour imiter les conditions in vivo.
Fait intéressant, l’idée des organoïdes n’est pas nouvelle. Aujourd’hui, la technologie des organoïdes est le fruit de décennies de recherche. En fait, les fondements du concept remontent au début du 20e siècle.
Voici un bref aperçu de l’histoire des organoïdes et de la façon dont Molecular Devices s’est retrouvé sur la bonne voie grâce à ses solutions de recherche approfondies sur les organoïdes.
Avant la cellule souche : Auto-organisation et réagrégation
L’auto-organisation des cellules a été observée pour la première fois par Henry Van Peters Wilson en 1907. En faisant des recherches pour le Bureau américain de la pêche, il a découvert que dans certaines conditions, les cellules éponges siliceuses se dégénèrent en masses indifférenciées de tissus qui, à leur tour, pourraient s’auto-organiser et se différencier en éponges parfaites.2 Cette expérience a démontré que les cellules contiennent les informations permettant de créer une structure multicellulaire sans indices externes ni besoin d’une disposition anatomique spécifique.
Au cours des décennies suivantes, d'autres groupes de recherche ont observé des modèles similaires de dissociation-réagrégation avec des organismes rentables et bien étudiés, tels que les pronéphroses amphibiens (rénal primaire) en 19443et les cellules de poussin embryonnaire en 1960.4 Ces expériences ont montré que l’auto-organisation observée par Wilson se produit également dans les modèles de vertébrés.
La première théorie scientifique pour la régénération cellulaire est apparue en 1964 lorsque Malcolm Steinberg a émis l’hypothèse que les cellules étaient auto-organisées selon la « thermodynamique médiée par l’adhésion différentielle de la surface ».5 Il a proposé que les cellules qui expriment le même « système adhésif » adhèrent plus fortement les unes aux autres que les cellules qui expriment différents systèmes adhésifs. Ainsi, les mélanges cellulaires se réagrégeraient en fonction de leur type d’adhésif. Des preuves ultérieures ont cependant montré que la réagrégation cellulaire nécessite plus que la simple thermodynamique et nécessite des mécanismes cellulaires supplémentaires.
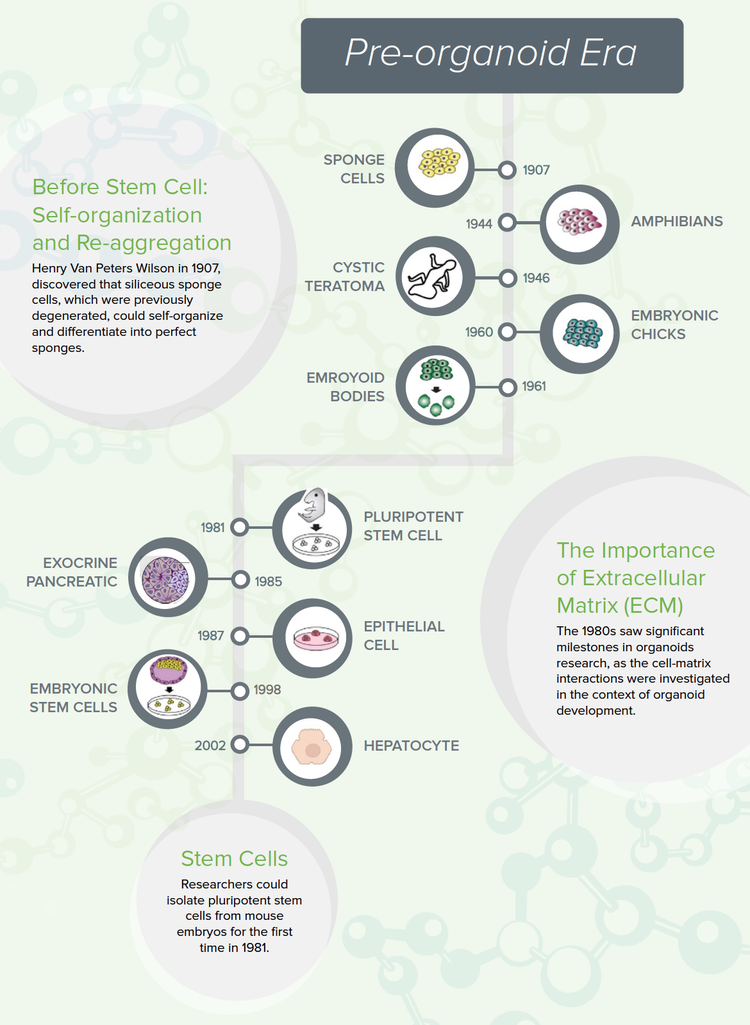
Importance de la matrice extracellulaire (MEC)
Les années 1980 ont connu des étapes importantes dans la recherche sur les organoïdes, car les interactions cellule-matrice ont été étudiées dans le contexte du développement d’organoïdes.
Pour éviter que la culture cellulaire ne soit contaminée par le plat en plastique, les chercheurs ont commencé à utiliser des échafaudages, des hydrogels qui imitent la MEC naturelle. Plus important encore, une MEC fournirait à la cellule les protéines nécessaires pour signaler l’adhésion et la différenciation.
En 1987, l’importance de la MEC a été soulignée par Li et al., qui ont utilisé du matrigel EHS (Engelbreth-Holm-Swarm) à partir de cellules de sarcome de souris, constitué de protéines adhésives que l’on trouve généralement dans la MEC humaine. En utilisant le milieu EHS, ils pouvaient faire évoluer l’épithélium mammaire en canaux et ductules 3D entièrement formés, qui présentaient une sécrétion de protéines de lait.6
Shannon et al. ont utilisé la même stratégie de MEC pour démontrer la différenciation fonctionnelle des cellules épithéliales alvéolaires de type II.7
Recherche sur les cellules souches
Avant le développement des cellules souches, la formation d’organoïdes humains dépendait de l’utilisation de fragments tissulaires isolés de l’homme. La recherche sur les cellules souches s’est simultanément développée dans les années 80. Par exemple, les chercheurs peuvent isoler des cellules souches pluripotentes d’embryons de souris pour la première fois en 1981.
Le développement des premières lignées de cellules souches embryonnaires humaines (Thomson et al.1998) et plus tard des lignées de cellules souches pluripotentes induites par l’homme (hiPSC) a joué un rôle déterminant dans la recherche sur les organoïdes. Plus important encore, l’hiPSC peut être différenciée en divers types de cellules dans un milieu conditionné avec des facteurs8 de croissance spécifiques qui fournissent les matériaux de départ pour la croissance d’organoïdes à grande échelle. Le facteur temporel temporel était également important pour créer des organoïdes. Ces observations étaient plus que suffisantes pour porter les cellules souches en première ligne de la recherche sur les organoïdes.
Cellules souches pluripotentes induites (iPSC)
Une cellule souche pluripotente induite, également appelée cellule iPS ou iPSC, est une cellule issue de tissus adultes, généralement dérivés de cellules de la peau ou de cellules sanguines, et génétiquement modifiée pour revenir à un état pluripotent de type embryonnaire. Développées pour la première fois à partir de cellules de peau de souris par l’équipe de Shinya Yamanaka à l’Université de Kyoto, au Japon, en 2006,9 les cellules iPS ont tenu leur promesse dans le domaine de la médecine régénérative.
Les cellules souches pluripotentes peuvent se propager ou se renouveler indéfiniment et peuvent se différencier en tout type de cellule adulte dans l’organisme, comme les neurones ou les cellules cardiaques, pancréatiques et hépatiques. Et comme les iPSC peuvent être dérivées directement de tissus adultes, elles peuvent être fabriquées de manière adaptée au patient, ce qui signifie que des modèles cellulaires importants liés à la maladie peuvent être créés avec un gène muté, qui peut cribler l’efficacité d’un médicament ou la sensibilité d’un patient individuel peut être testée dans des cellules dérivées de patients. Chaque individu pourrait potentiellement avoir sa propre lignée de cellules souches pluripotentes offrant une source unique de cellules pour remplacer le cœur ou le tissu hépatique endommagé. Imaginez des iPSC générés à partir de cellules sanguines qui pourraient créer du sang exempt de cellules cancéreuses pour un patient atteint de leucémie, ou des neurones pour traiter des troubles neurologiques.

Après cellule souche : Recherche moderne sur les organoïdes
L’isolation des cellules souches a accéléré la recherche sur les organoïdes et ouvert de nombreuses portes. Les organoïdes dérivés de cellules souches étaient beaucoup plus efficaces dans la surveillance de la réponse immunitaire que les biopsies de patients, ce qui signifie qu’ils étaient beaucoup plus pertinents pour la modélisation de la maladie.
En 2008, Sasai et.al a posé les bases des organoïdes cérébraux en démontrant l’auto-organisation des iPSC du cerveau humain en cellules neuronales qui ont formé des tissus corticaux polarisés.10
2009 a été une autre année significative pour la recherche moderne sur les organoïdes. Sato et al. ont démontré pour la première fois que les cellules souches adultes intestinales (ASC) pouvaient s’auto-organiser et se différencier pour former des structures de crypte-villus intestinales qui contenaient tous les différents types de cellules intestinales.11
Trois ans plus tard, le même laboratoire de recherche a également planté les semences de la thérapie par cellules souches en démontrant la transplantabilité des organoïdes intestinaux dans un côlon de souris endommagé. Les organoïdes transplantés pouvaient s’intégrer totalement dans le côlon de la souris avec un succès durable, même après six mois.12
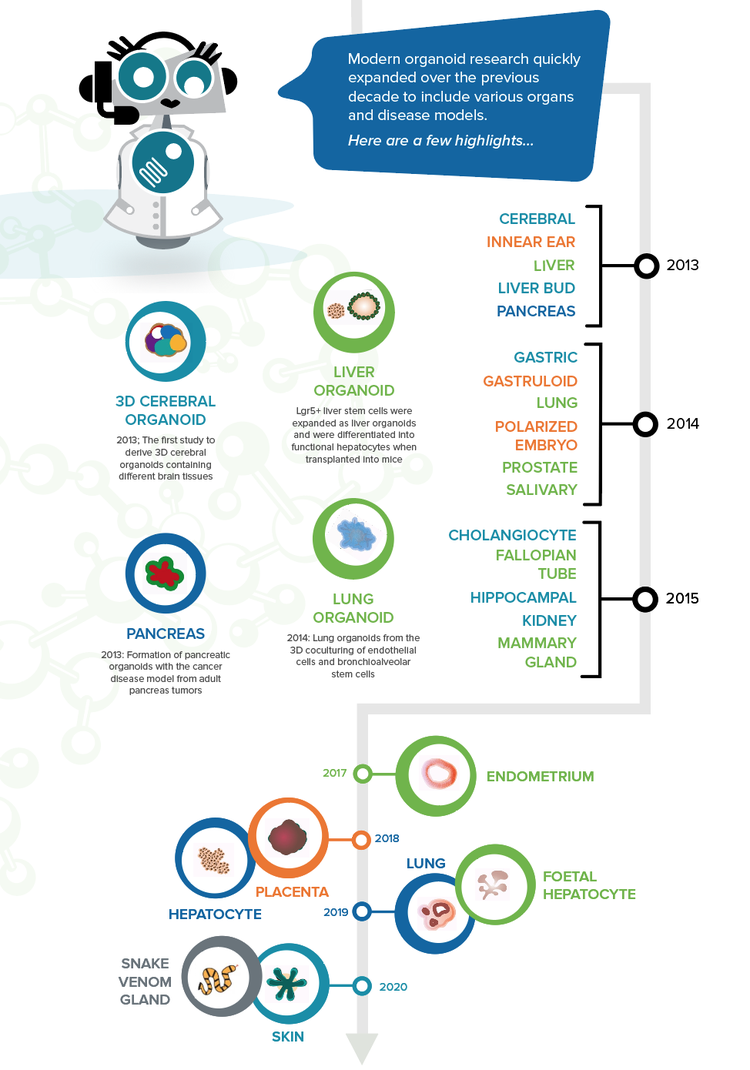
La recherche moderne sur les organoïdes s’est rapidement développée au cours de la dernière décennie pour inclure divers organes et modèles de maladie. Voici quelques faits marquants :
- 2010 – Organoïdes rénaux issus de cellules souches rénales dérivées de fœtus murins 13
- 2012 – Formation d’une structure de coupelle optique auto-organisée à partir d’ESC humaines en culture 3D
- 2013 – La première étude à dériver des organoïdes cérébraux 3D contenant différents tissus cérébraux 14
- 2014 – Organoïdes pulmonaires issus de la co-culture 3D de cellules endothéliales et de cellules souches bronchioalvéolaires 15
- 2013 – Les cellules souches hépatiques Lgr5+ ont été expansées sous forme d’organoïdes hépatiques et ont été différenciées en hépatocytes fonctionnels lorsqu’elles ont été transplantées chez la souris 16
- 2013 – Formation d’organoïdes pancréatiques avec le modèle de cancer à partir de tumeurs du pancréas adultes 17
Galerie d’images d’organoïdes
Voir plus d’images sur notre page d’application Organoïdes.
Recherche sur les organoïdes chez Molecular Devices
Au cours de la dernière décennie, les avancées dans le développement d’organoïdes ont explosé, générant plus que jamais des organoïdes complexes et semblables à la vie. Inévitablement, les techniques d’imagerie et d’analyse doivent suivre les évolutions continues. À mesure que les types d’échantillons passent des modèles cellulaires 2D aux modèles cellulaires 3D, les méthodes conventionnelles manqueront de résultats de haute qualité et d’acquisition rapide.
Molecular Devices s’efforce de rendre la recherche sur les organoïdes beaucoup plus réalisable en intégrant la caractérisation automatisée, l’imagerie haut contenu et des techniques d’analyse avancées dans une plateforme haut débit. Cette plateforme nous a permis d’automatiser des flux de travail pour diverses opérations, telles que la génération de cellules souches, la caractérisation d’organoïdes, le criblage de médicaments et l’évaluation de la toxicité, sur divers types d’organoïdes, du poumon au cerveau.

https://main--moleculardevices--hlxsites.hlx.page/applications/organoid-innovation-center
Consultez notre page d’application Organoïdes pour accéder à des notes détaillées sur la recherche d’organoïdes, des webinaires, des affiches et bien plus encore.
Le meilleur est que vous n’avez pas besoin d’être expert dans ces solutions. Le nouveau Centre d’innovation des organoïdes de Molecular Devices est un centre collaboratif où vous pouvez tester des flux de travail automatisés pour la culture et le criblage d’organoïdes, avec les conseils de scientifiques internes.
Consultez le Centre d’innovation des organoïdes pour en savoir plus sur les idées sur les organoïdes, les flux de travail automatisés et les collaborations révolutionnaires.
Références
- Grens, K. « Les grandes avancées scientifiques de 2013. The Scientist, New York ( 2013) : 110.Grens, K. « Les grandes avancées scientifiques de 2013. The Scientist, New York City (2013) : 110.
- Wilson, H. V. « Une nouvelle méthode par laquelle les éponges peuvent être artificiellement élevées. » Science 25,649 ( 1907) : 912-915.Wilson, H. V. « Une nouvelle méthode par laquelle les éponges peuvent être artificiellement élevées. » Science 25,649 (1907) : 912-915.
- Holtfreter, Johannes. « Études expérimentales sur le développement des pronéphroses. » Rév. can. biol. 3 (1943): 220-250.Holtfreter, Johannes. « Études expérimentales sur le développement des pronéphroses. » Rév. can. biol. 3 (1943) : 220-250.
- Weiss, Paul et A. C. Taylor. « Reconstitution d’organes complets à partir de suspensions de cellules uniques d’embryons de poussins aux stades avancés de la différenciation. » Procédures de l’Académie nationale des sciences des États-Unis d’Amérique 46,9 ( 1960) : 1177.Weiss, Paul et A. C. Taylor. « Reconstitution d’organes complets à partir de suspensions de cellules uniques d’embryons de poussins aux stades avancés de la différenciation. » Procédure de l’Académie nationale des sciences des États-Unis d’Amérique 46,9 (1960) : 1177.
- Steinberg, Malcolm S. « Le problème de la sélectivité adhésive dans les interactions cellulaires. » Membranes cellulaires en cours de développement. Vol. 22. Academic Press New York, 1964. 321-366.Steinberg, Malcolm S. « Le problème de la sélectivité adhésive dans les interactions cellulaires. » Membranes cellulaires en cours de développement. Vol. 22. Academic Press New York, 1964. 321-366.
- Li, Ming Liang, et al. « Influence d’une membrane basale reconstituée et de ses composants sur l’expression et la sécrétion du gène caséine dans les cellules épithéliales mammaires de souris. » Procédures de l’Académie nationale des sciences 84,1 ( 1987) : 136-140.Li, Ming Liang, et al. « Influence d’une membrane basale reconstituée et de ses composants sur l’expression et la sécrétion du gène caséine dans les cellules épithéliales mammaires de souris. » Procédure de l’Académie nationale des sciences 84,1 (1987) : 136-140.
- Shannon, John M., Robert J. Mason et Susan D. Jennings. « Différenciation fonctionnelle des cellules épithéliales alvéolaires de type II in vitro : effets de la forme cellulaire, des interactions cellule-matrice et des interactions cellule-cellule. » Recherche sur les cellules moléculaires Biochimica et Biophysica Acta (BBA) 931,2 ( 1987) : 143-156.Shannon, John M., Robert J. Mason et Susan D. Jennings. « Différenciation fonctionnelle des cellules épithéliales alvéolaires de type II in vitro : effets de la forme cellulaire, interactions cellule-matrice et interactions cellule-cellule. » Biochimica et Biophysica Acta (BBA)-Recherche sur les cellules moléculaires 931,2 (1987) : 143-156.
- Martin, Gail R. « Isolement d’une lignée cellulaire pluripotente à partir d’embryons de souris cultivés dans un milieu conditionné par des cellules souches de tératocarcinome. » Procédures de l’Académie nationale des sciences 78,12 ( 1981) : 7634-7638.Martin, Gail R. « Isolation d’une lignée cellulaire pluripotente à partir d’embryons de souris cultivés dans un milieu conditionné par des cellules souches de tératocarcinome. » Procédures de l’Académie nationale des sciences 78,12 (1981) : 7634-7638.
- Takahashi K, Yamanaka S (août 2006). « Induction de cellules souches pluripotentes à partir de cultures de fibroblastes embryonnaires et adultes de souris par des facteurs définis ». Cellule. 126 (4): 663–76.Takahashi K, Yamanaka S (août 2006). « Induction de cellules souches pluripotentes à partir de cultures de fibroblastes embryonnaires et adultes de souris par des facteurs définis ». Cellule. 126 (4) : 663-76.
- Eiraku, Mototsugu, et al. « Formation auto-organisée de tissus corticaux polarisés à partir des ESC et sa manipulation active par des signaux extrinsèques. » Cellules souches 3,5 ( 2008) : 519-532.Eiraku, Mototsugu, et al. « Formation auto-organisée de tissus corticaux polarisés à partir des ESC et manipulation active par des signaux extrinsèques. » Cellules souches 3,5 (2008) : 519-532.
- Sato, Toshiro, et al. « Les cellules souches Single Lgr5 construisent des structures de crypte-villus in vitro sans niche mésenchymateuse. » Nature 459,7244 ( 2009) : 262-265.Sato, Toshiro, et al. « Les cellules souches Single Lgr5 construisent des structures de crypte-villus in vitro sans niche mésenchymateuse. » Nature 459,7244 (2009) : 262-265.
- Yui, Shiro, et al. « Greffon fonctionnel de l’épithélium du côlon expansé in vitro à partir d’une seule cellule souche Lgr5+ adulte. » Médecine de la nature 18,4 ( 2012) : 618-623.Yui, Shiro, et al. « La greffe fonctionnelle de l’épithélium du côlon s’est développée in vitro à partir d’une seule cellule souche Lgr5+ adulte. » Médecine de la nature 18,4 (2012) : 618-623.
- Unbekandt, Mathieu et Jamie A. Davies. « La dissociation des reins embryonnaires suivie d’une réagrégation permet la formation de tissus rénaux. » Rein international 77,5 ( 2010) : 407-416.Unbekandt, Mathieu et Jamie A. Davies. « La dissociation des reins embryonnaires suivie d’une réagrégation permet la formation de tissus rénaux. » Rein international 77,5 (2010) : 407-416.
- Lancaster, Madeline A., et al. « Les organoïdes cérébraux modélisent le développement du cerveau humain et la microcéphalie. » Nature 501,7467 ( 2013) : 373-379.Lancaster, Madeline A., et al. « Les organoïdes cérébraux modélisent le développement du cerveau humain et la microcéphalie. » Nature 501,7467 (2013) : 373-379.
- Lee, Joo-Hyeon, et al. « Différenciation des cellules souches pulmonaires chez les souris dirigées par des cellules endothéliales via un axe BMP4-NFATc1-thrombospondin-1. » Cellule 156,3 ( 2014) : 440-455.Lee, Joo-Hyeon, et al. « Différenciation des cellules souches pulmonaires chez les souris dirigées par des cellules endothéliales via un axe BMP4-NFATc1-thrombospondin-1. » Cellule 156,3 (2014) : 440-455.
- Huch, Meritxell, et al. « Expansion in vitro de cellules souches hépatiques Lgr5+ uniques induite par la régénération induite par Wnt. » Nature 494,7436 ( 2013) : 247-250.Huch, Meritxell, et al. « Expansion in vitro de cellules souches hépatiques Lgr5+ uniques induite par la régénération Wnt-driven. » Nature 494,7436 (2013) : 247-250.
- Greggio, Chiara, et al. « Les niches artificielles tridimensionnelles détruisent le développement du pancréas in vitro. » Développement 140,21 ( 2013) : 4452-4462.Greggio, Chiara, et al. « Les niches artificielles tridimensionnelles détruisent le développement du pancréas in vitro. » Développement 140,21 (2013) : 4452-4462.