Vue d’ensemble de TRF/TR-FRET (HTRF)
Fluorescence en temps résolu (TRF)
Les mesures d’intensité de la fluorescence (FI) utilisent des fluorophores standard comme la fluorescéine, dont l’émission est brève, de l’ordre des nanosecondes. L’excitation de l’échantillon et la mesure de l’émission ont lieu simultanément. Bien que les lecteurs de microplaques soient très efficaces pour écarter la lumière d’excitation de la mesure d’émission, cette lumière d’excitation, avec la brève lumière émise par les matériaux dans le puits ou l’échantillon, contribue souvent à un bruit de fond élevé.
La fluorescence en temps résolu (TRF) réduit le bruit de fond en utilisant un fluorophore lanthanidique, tel que l’europium ou le terbium, qui émet une fluorescence longue. Cette fluorescence longue dure plusieurs millisecondes. Par conséquent, l’excitation du fluorophore par une source lumineuse pulsée (p. ex., lampe flash), suivie d’un délai, puis de la mesure du signal (« fenêtre de comptage »), permet à la fluorescence brève (ne durant que quelques nanosecondes) de s’atténuer avant de réaliser une mesure. Les tests utilisant la fluorescence en temps résolu permettent d’obtenir des rapports signal/bruit considérablement plus élevés. Les lanthanides les plus fréquemment utilisés sont l’europium, le terbium et le samarium. Ils sont généralement utilisés comme complexes de type chélate ou cryptate permettant une bonne intensité et une bonne stabilité du signal.
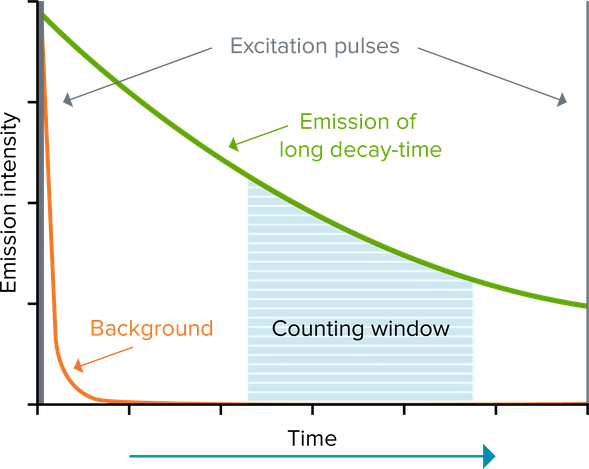
Transfert d’énergie par résonance de fluorescence en temps résolu (TR-FRET)

sans FRET FRET
Le donneur et l’accepteur sont distants Le donneur et l’accepteur sont très proches
Le TR-FRET combine la mesure de la fluorescence en temps résolu (TR) à la technologie de transfert d’énergie par résonance par fluorescence (FRET). Dans les tests FRET, des biomolécules (p. ex., protéines) sont marquées avec des fluorophores donneurs et accepteurs. Lorsque les biomolécules interagissent, les fluorophores donneurs et accepteurs se rapprochent. Lorsque le donneur est excité, il peut transférer son énergie d’émission à l’accepteur, qui, à son tour, émet une fluorescence à une longueur d’onde spécifique. Les émissions de fluorescence du donneur et de l’accepteur ont différentes longueurs d’onde pouvant être différenciées les unes des autres au moyen d’un lecteur de microplaques, ce qui permet la quantification de l’interaction biomoléculaire.
En utilisant comme donneurs des fluorophores lanthanidiques, qui ont une émission de fluorescence longue, les tests de TR-FRET tirent partie de la mesure de la fluorescence en temps résolu pour éliminer la fluorescence de fond brève. Dans un test TR-FRET, grâce à l’émission longue du fluorophore donneur, l’excitation et l’émission des fluorophores donneurs et accepteurs peuvent également être mesurées après que la fluorescence de fond brève a diminué.
Fluorescence homogène en temps résolu (HTRF)
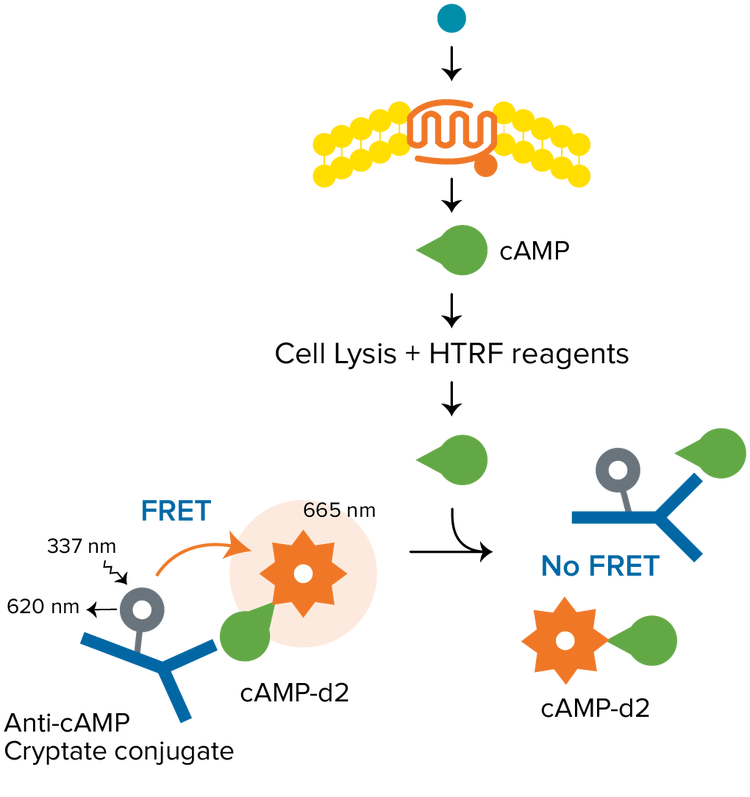
La technologie HTRF est une technologie TR-FRET polyvalente développée par Cisbio pour détecter les interactions biomoléculaires. Habituellement, le test HTRF utilise un cryptate d’europium comme donneur, et le fluorophore organique d2 comme accepteur. Le donneur et l’accepteur peuvent être utilisés pour marquer un grand nombre de biomolécules, pour des applications comprenant l’épigénétique, la quantification des biomarqueurs, la signalisation des GPCR, et bien plus encore. Les tests HTRF requièrent un lecteur de microplaques avec mode de détection TRF certifié compatible HTRF par Cisbio.
Avantages et éléments à prendre en considération
Un avantage clé de la détection TRF et TR-FRET est la diminution du bruit de fond et l’augmentation du rapport signal/bruit par rapport à la fluorescence standard, résultant en sensibilité accrue. En outre, le test est doté d’un format « mix-and-read » robuste ne nécessitant pas de lavage. Ceci, en plus de la stabilité du test, facilite l’automatisation et la miniaturisation pour les applications de criblage.
Applications et tests
Les tests TRF et TR-FRET (HTRF) permettent l’analyse des interactions moléculaires dans les processus biochimiques et sont largement utilisés pour étudier les tests d'activité kinase, les voies de signalisation cellulaire, les interactions protéine-protéine, les interactions ADN-protéine, la cytotoxicité cellulaire et la liaison ligand-récepteur.
Des exemples de test TR-FRET sont présentés dans le tableau à droite, et vous trouverez ci-dessous plusieurs ressources sur la fluorescence en temps résolu.