
Polarisation de fluorescence (FP)
Polarisation de fluorescence (FP)
La polarisation de fluorescence (PF) est une technique très utilisée pour suivre les événements de liaison dans les solutions. Elle peut être utilisée pour évaluer les interactions biomoléculaires, notamment la liaison protéine-anticorps et l’hybridation de l’ADN, ainsi que l’activité enzymatique, et elle a été adaptée à la recherche de base, ainsi qu’au criblage haut débit.
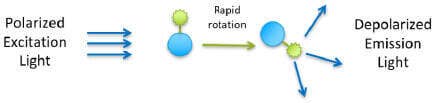
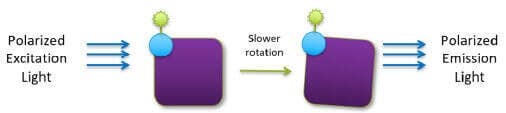
Une petite molécule marquée par fluorescence (traceur) excitée avec une lumière polarisée dans un plan émet une lumière pratiquement dépolarisée car le traceur chute rapidement dans le temps entre l’excitation et l’émission. Toutefois, lorsque le traceur se lie à une molécule beaucoup plus grosse, il tourne plus lentement et la lumière émise reste très polarisée.
Facteur G de polarisation de fluorescence
La polarisation, exprimée en unités de milli P, ou mP, est calculée à partir des mesures des valeurs d’intensité de fluorescence parallèle (Ipara) et perpendiculaire (Iperp) détectées par rapport au sens de la lumière d’excitation polarisée (voir la formule ci-dessous). Le facteur G (G) est utilisé pour corriger les effets des composants optiques tels que les filtres, les polariseurs et les monochromateurs, qui peuvent influencer les valeurs de polarisation.
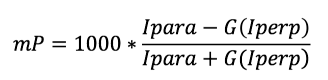
Traceur non lié
Traceur lié à une plus grosse molécule
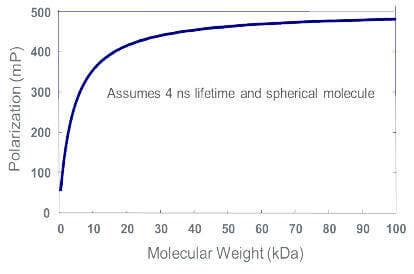
Plus la molécule marquée par fluorescence est grosse, ou plus la molécule à laquelle le traceur est lié est grosse, plus la valeur mP est élevée.
La PF est avantageuse par rapport aux autres tests de liaison
La PF peut être utilisée pour étudier les interactions récepteur-ligand, les interactions protéine-ADN, la protéolyse, la fluidité membranaire, les tests enzymatiques, et bien plus encore. Les tests de PF sont utilisés avec succès pour étudier un grand nombre de cibles, notamment les kinases, les phosphatases, les protéases, les récepteurs couplés aux protéines G (GPCR) et les récepteurs nucléaires.
Les avantages suivants rendent les tests de PF particulièrement adaptés au criblage haut débit :
- Homogènes (aucune étape de lavage n’est nécessaire)
- Non radioactifs
- Ratiométriques (longueur d’onde unique)
- Miniaturisables
Tests de phosphodiestérase IMAP sur les lecteurs de microplaques multimode SpectraMax
La technologie IMAP® de Molecular Devices permet un test non radioactif, homogène et rapide des kinases, des phosphatases et des phosphodiestérases, et convient au développement de tests et au criblage haut débit. Les tests IMAP se basent sur la liaison du phosphate à des complexes de coordination métalliques immobilisés sur des nanoparticules. Lorsque les entités de liaison IMAP se lient à un substrat phosphorylé, le mouvement moléculaire du peptide est altéré, et la polarisation de fluorescence (PF) pour le marquage fluorescent lié au peptide augmente (Figure 1, à gauche). Dans une version TR-FRET du test, l’inclusion d’un donneur de Terbium (Tb) permet la production d'un transfert d’énergie fluorescente lorsqu’un substrat phosphorylé est présent (Figure 1, à droite). Ce test est détecté dans un mode en temps résolu, ce qui élimine pratiquement l’interférence de la fluorescence des composants du test ou des composés dans un criblage. TR-FRET offre également une certaine flexibilité au niveau de la concentration et de la taille du substrat.
Les PDE (phosphodiestérases) des nucléotides cycliques forment un groupe d’enzymes qui dégradent la liaison phosphodiester du cAMP et du cGMP, les messagers secondaires participant à un grand nombre de processus biologiques. Elles se sont imposées en tant que classe principale de cibles thérapeutiques en raison de leur signification clinique dans certains domaines, notamment la maladie cardiaque, la démence, la dépression, et bien d’autres encore. Ici, nous indiquons comment les courbes d’inhibition et de dilution enzymatique PDE sont créées avec la technologie IMAP en utilisant les lecteurs de microplaques multimode SpectraMax® avec SoftMax® Pro Software.
Principe des tests de phosphodiestérase IMAP PF et TR-FRET
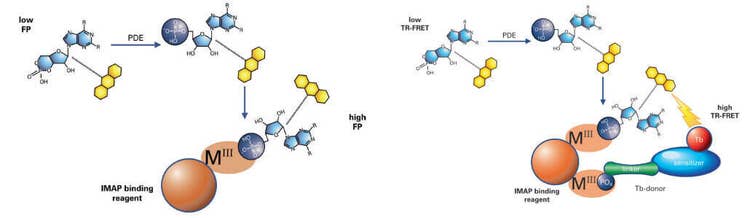
Figure 1 : Une réaction de phosphodiestérase se produit en utilisant un substrat marqué par fluorescence. Une solution de liaison contenant de grosses nanoparticules à base de M(III) est ensuite ajoutée. Dans le résultat de PF (à gauche), le petit substrat fluorescent phosphorylé se lie aux grosses nanoparticules, ce qui réduit la vitesse de rotation du substrat et augmente par conséquent sa polarisation de fluorescence. Dans le résultat de TR-FRET (à droite), le substrat phosphorylé et le donneur Tb se lient tout deux à la nanoparticule, rapprochant étroitement le donneur Tb de l’accepteur de fluorescéine sur le substrat et permettant le FRET.
Optimisez le flux de travail de la mesure des IgG dans le développement des lignées cellulaires
La mesure de la production d’IgG est une étape cruciale de nombreuses phases du développement et de la fabrication des anticorps monoclonaux. Les méthodes couramment utilisées pour la quantification des IgG requièrent soit des instruments spéciaux et du personnel expérimenté, (p. ex., CLHP et interférométrie de surface), soit des tests chronophages comme les tests ELISA (dosages d’immunoabsorption enzymatique). Bien que le test ELISA soit une méthode bien établie pour la quantification des protéines, il s’agit d’un processus à plusieurs étapes fastidieux. Ici, nous présentons l’utilisation du test Valita®TITER de Valitacell destiné à la mesure des titres d’IgG au cours du développement des anticorps et du processus de fabrication.
Le test ValitaTITER se base sur la détection des interactions IgG Fc avec la protéine G en utilisant la polarisation de fluorescence (PF). Chaque puits d’une plaque de microtitrage de 96 puits est enduit d’un peptide liant l’IgG marqué par fluorescence, la protéine G. Lorsque les échantillons sont ajoutés aux puits, les molécules de la protéine G sont de nouveau mises en suspension et la liaison a lieu. La vitesse de mouvement moléculaire de la protéine G ralentit lorsqu’elle est liée à des anticorps ce qui entraîne une augmentation de la valeur de PF (Figure 2).
Principe du test ValitaTITER utilisant la PF
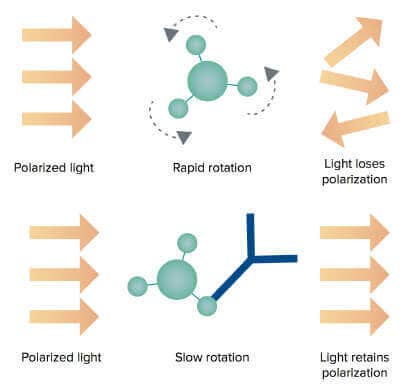
Figure 2 : Les molécules de protéine G libres sont plus petites et tournent plus rapidement dans la solution tampon. Ainsi, la lumière d’excitation polarisée perd sa polarisation (en haut). Lorsque les molécules de protéine G se lient aux anticorps dans les échantillons, la rotation du complexe plus gros ralentit, ce qui entraîne une augmentation des valeurs de PF (en bas).