7 conseils pour optimiser votre protocole d’analyse et d’imagerie cellulaires 3D
Alors que le domaine de la biologie cellulaire s’oriente vers une complexité croissante des tests, les systèmes cellulaires 3D se sont avérés fournir des informations plus pertinentes d’un point de vue physiologique par rapport aux tests 2D traditionnels pour la découverte de médicaments et la modélisation des maladies. Dans les systèmes 2D traditionnels, les cellules s’étirent, adhèrent et se développent sur une surface plane, tandis que les systèmes 3D imitent mieux l’environnement tissulaire in vivo par le biais d’interactions cellule/cellule/MEC, de pénétration des composés et de dose-réponse.
La complexité croissante des tests 3D pose de nouveaux défis liés à l’imagerie cellulaire, tels que des temps d’acquisition et d’analyse d’images plus longs, ainsi que des exigences accrues en matière de stockage des données. En utilisant les bons outils et techniques, vous pouvez surmonter ces défis et obtenir des données fiables de manière plus efficace.
Voici sept conseils pour optimiser votre flux de travail d’imagerie et d’analyse cellulaires 3D.
1. Utiliser les instruments et la technologie appropriés pour l’imagerie de cultures cellulaires 3D
Lorsque vous travaillez avec des cultures cellulaires 3D, il ne suffit pas d’acquérir une image d’un plan cellulaire, comme dans les cultures cellulaires 2D traditionnelles. Au lieu de cela, vous devez prendre une gamme d’images dans des plans verticaux (généralement 10à15 images), appelée Z-Stack. Les plateformes d’imagerie confocale automatisées, telles que le système d’imagerie à haut contenu ImageXpress® Micro Confocal , vous permettent de réaliser des images d’une section optique plus fine de la structure 3D et de réduire significativement le trouble du bruit de fond, ce qui permet une meilleure résolution de l’image et des détails cellulaires plus fins. Les objectifs à immersion dans l’eau du système ImageXpress jouent également un rôle clé dans l’amélioration de la qualité des images.
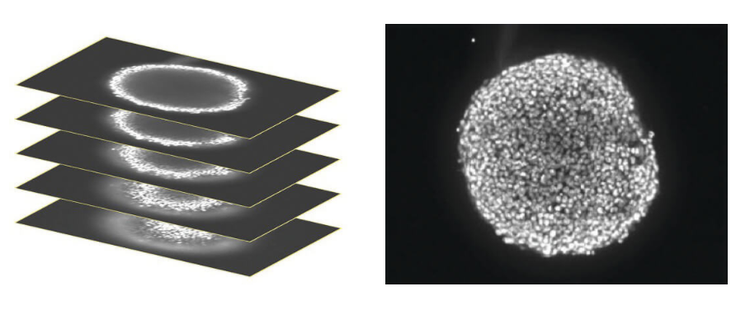
Une pile d’images confocales a été acquise dans le plan Z couvrant environ la moitié de la profondeur du sphéroïde (à gauche). Seules certaines cellules du sphéroïde sont mises au point sur un plan donné. Par conséquent, pour faciliter l’analyse, les images ont été réduites en une seule image 2D pour combiner les zones de mise au point (droite).
2. Utilisez des microplaques spécialement conçues pour l’imagerie 3D
Il est important d’utiliser des microplaques conçues spécifiquement pour l’imagerie 3D . Généralement, il 96s’agit 384de plaques à fond clair ou puits. Les plaques rondes à fond en U de Corning sont pratiques pour la fabrication de sphéroïdes et sont également idéales pour l’imagerie 3D. Ces plaques vous permettent de maintenir le sphéroïde centré et en place pendant l’acquisition des images. Les plaques à fond plat, en revanche, ont tendance à être problématiques, car elles rendent difficile le maintien du centrage de l’échantillon.
3. Suivre les techniques de préparation cellulaire appropriées avant l’imagerie
Il est important de tenir compte du type d’échantillon 3D que vous utilisez, car différents échantillons ont des exigences de préparation et d’imagerie différentes. Lorsque vous traitez des objets solides, tels que des sphéroïdes ou des échantillons de tissus épais, il existe une distance limitée que vous pouvez visualiser en raison de la pénétration limitée de la lumière et de la diffusion de la lumière qui provoque des interférences des cellules. Sinon, les cellules dans des matrices telles que Matrigel sont transparentes, ce qui vous permet de visualiser l’objet et d’effectuer une analyse avec une plus grande pénétration de la lumière.
La coloration d’objets cellulaires 3D tels que les sphéroïdes peut être délicate, car les colorants doivent pénétrer non seulement à la surface, mais aussi à l’intérieur de l’échantillon. Dans le cas du colorant Hoechst, qui est utilisé pour la coloration nucléaire, vous devrez peut-être utiliser une concentration 2X-3X plus importante pour obtenir une pénétration efficace. À son tour, vous devrez peut-être prévoir une durée de coloration plus longue. Généralement, un colorant tel que Hoechst nécessite 15à20 minutes pour la coloration. Toutefois, lorsque vous traitez des sphéroïdes, vous devrez peut-être compter 2à3 heures pour la coloration. Certains colorants sont lipophiles et peuvent se bloquer à la surface au lieu de pénétrer dans l’échantillon. La coloration avec des anticorps est particulièrement difficile et les scientifiques travaillent toujours à développer des protocoles de coloration efficaces.
4. Trouvez la position centrale de votre échantillon 3D au début de l’acquisition d’images
Pour démarrer le processus d’imagerie, vous devez d’abord trouver la position de l’objet au centre du site d’imagerie et trouver la première mise au point qui serait environ au milieu de la position Z (position verticale). Par exemple, si vous imageriez un sphéroïde dont le diamètre est d’environ 500 microns, la position de départ serait d’environ 50 microns au-dessus du fond du puits. À cette position de départ, vous pouvez alors ajuster votre exposition et vos décalages pour différents canaux.
Parfois, les sphéroïdes deviennent décentrés, il peut donc être nécessaire d’ajuster les dimensions de la plaque pour s’assurer que les sphéroïdes sont centrés. Vous pouvez également vérifier sur la plaque à différents coins pour vous assurer que les sphéroïdes sont bien visibles.
5. Définissez la plage de votre acquisition d’images 3D, du début à la fin
Cela implique l’acquisition d’une pile d’images à différentes profondeurs dans l’objet et la définition précise de l’endroit où vous devez commencer, de l’endroit où vous devez terminer, ainsi que la définition du nombre d’étapes entre les deux. Généralement pour un objectif 10X, vous pouvez commencer avec une distance de 8à10 μm entre les étapes. Pour un objectif 20X, vous commenceriez par une distance de 3à5 μm entre les étapes, et ainsi de suite.
Bien que l’augmentation du nombre d’étapes améliore la qualité de l’analyse et de la visualisation, un nombre excessif d’images peut prolonger votre temps d’acquisition et d’analyse et surcharger le stockage des données. De plus, la prise d’un trop grand nombre d’images peut entraîner la décoloration de votre échantillon. En fin de compte, il s’agit d’expérimenter pour trouver le bon équilibre. Généralement, j’utilise deux protocoles différents pour une seule plaque. L’une utilise une plus grande distance entre les coupes et l’autre utilise moins.
Il est également très important de spécifier le type d’image de projection que vous souhaitez prendre au début de l’acquisition. Généralement pour l’imagerie confocale, l’objet est réglé sur « image de projection maximale », ce qui génère automatiquement de nombreuses informations concernant l’échantillon. À ce stade, vous pouvez choisir d’analyser uniquement l’image de projection au lieu de l’analyse 3D pour accélérer le processus.
6. Utilisez QuickID et des objectifs à immersion dans l’eau pour réduire votre temps d’acquisition d’images
Pendant l’acquisition, les objets 3D peuvent s’éloigner du centre du puits, ce qui les rend difficiles à trouver. Ceci est particulièrement vrai si vous traitez des sphéroïdes dans des plaques à fond plat. Pour surmonter ce défi, notre système ImageXpress Micro Confocal comprend une fonction appelée acquisition d’images ciblée QuickID . Le système image avec un faible grossissement pour trouver l’objet d’intérêt, puis acquiert automatiquement l’objet d’intérêt dans un seul champ de vision avec un grossissement plus élevé. Cela réduit significativement le temps d’acquisition et les exigences de stockage des données. L’utilisation d’objectifs à immersion dans l’eau est également bénéfique, car ils collectent un signal plus élevé à partir de l’échantillon 3D, ce qui vous permet de réduire votre temps d’exposition et d’augmenter la vitesse d’acquisition.


7. Utiliser le logiciel d’analyse 3D approprié
Nos systèmes d’imagerie cellulaire comprennent le logiciel d’acquisition et d’analyse d’images haut contenu MetaXpress® , qui fournit de nombreux outils pour rendre l’analyse plus fluide. L’approche la plus simple consisterait à combiner les zones de mise au point de votre pile d’images en une seule projection 2D à l’aide de l’algorithme de projection maximale du logiciel. Vous pouvez utiliser des outils pour l’analyse 2D normale, tels que le comptage des noyaux, la quantification cellulaire et l’excroissance des neurites.
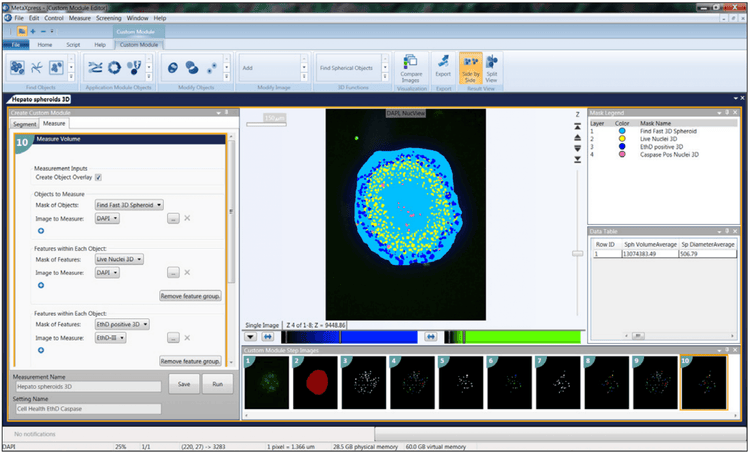
Pour l’analyse 3D, vous pouvez trouver des objets d’intérêt dans chaque Z-Stack, puis les combiner. Par exemple, si vous travaillez avec des sphéroïdes ou des cellules dans Matrigel, l’outil « Trouver un objet rond » vous permet de trouver l’objet en une seule étape une fois que vous avez défini la taille approximative de l’objet et le seuil d’intensité. Un autre outil courant est « Connecter par la meilleure correspondance ». Ici, vous sélectionnez votre protocole d’analyse (p. ex., comptage des noyaux, marquage des cellules vivantes/mortes ou marquage des cellules) et l’exécutez séparément pour chaque coupe Z. L’algorithme connecte ensuite certains objets entre les coupes Z adjacentes dans un volume 3D basé sur le décalage maximal des objets entre les coupes que vous désignez comme acceptables. Vous pouvez ensuite visualiser vos objets dans un format 3D et, plus important encore, vous pouvez effectuer une analyse volumétrique 3D pour identifier le volume, la distance entre les objets, etc.
Pour en savoir plus sur l’optimisation de votre flux de travail d’imagerie et d’analyse cellulaires 3D, consultez notre page Web Modèles cellulaires 3D.