
Conseils pour réussir un test d’imagerie sur cellules vivantes
Ces dix dernières années, il y a eu d’importantes avancées dans les domaines de la microscopie et de la technologie des caméras, ainsi que dans le domaine des technologies de marquage des molécules d’intérêt. Ces avancées ont conduit à une prévalence accrue de l’imagerie des cellules vivantes dans divers domaines, de la recherche fondamentale aux études avancées en neurobiologie, en biologie du développement, en recherche sur le canceret en développement de médicaments. Dans ces domaines, l’imagerie de cellules vivantes peut être utilisée pour étudier les processus cellulaires qui se déroulent sur une période allant du niveau de l’organisme entier au niveau moléculaire.
Bien qu’il existe de nombreuses applications pour l’imagerie de cellules vivantes et de nombreuses méthodes de microscopie différentes qui peuvent être utilisées, un défi courant est de maintenir l’intégrité de l’échantillon au cours de l’expérience tout en faisant l’acquisition d’images avec une résolution suffisante. Ces deux facteurs sont essentiels pour obtenir des données pertinentes et reproductibles à partir de vos expériences d’imagerie de cellules vivantes.
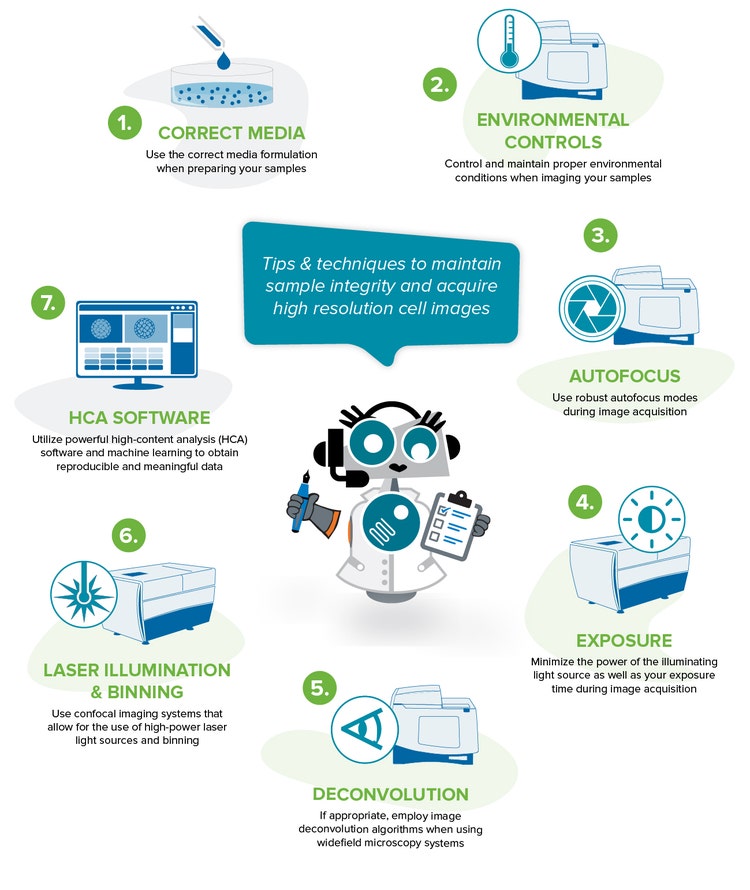
Meilleures pratiques pour obtenir des données pertinentes et reproductibles
Voici quelques conseils et techniques pour vous aider à maintenir la santé de votre échantillon et à mener une expérience d’imagerie de cellules vivantes réussie.
1. Utilisez la bonne formulation de milieu lors de la préparation de vos échantillons
En plus de garantir que les formulations de milieu contiennent les nutriments appropriés pour favoriser la croissance et le développement des cellules, il est essentiel de tenir compte de facteurs tels que le pH, la capacité tampon et l’osmolarité pour mener une expérience d’imagerie de cellules vivantes réussie. Les variations du pH et de l’osmolarité du milieu (c.-à-d. la quantité de soluté à l’intérieur de la solution du milieu) peuvent affecter l’expression des cellules, leur phénotype et, en fin de compte, leur apparence et leur comportement. La régulation et le maintien de conditions environnementales optimales permettront d’éviter les changements indésirables ou nocifs du milieu.
De plus, il existe de nombreux facteurs dans le milieu qui peuvent contribuer à l’autofluorescence de notre signal de fond élevé dans vos images. Envisagez d’utiliser un milieu sans phénol rouge et de réduire la concentration de sérum. Cela réduira considérablement le signal de fond.
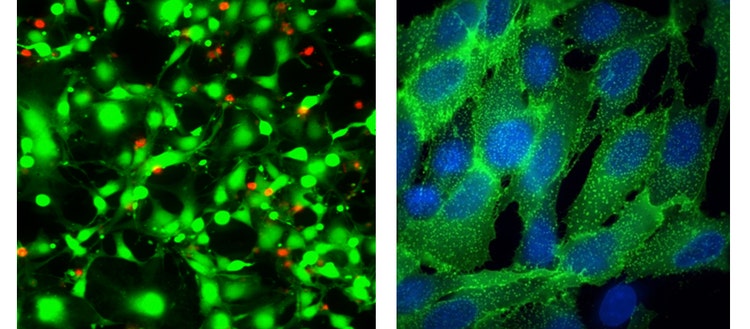
À gauche : Image 40X Plan Apo de cellules HeLa traitées avec de la straurosporine pendant 18 heures, puis colorées avec le test EarlyToxκ Live Dead – calcéine AM (verte) et homodimer-III d’éthidium (rouge)
À droite : Images 100X Plan Apo (air) de Transfluor U2OS traité avec de l'isoprotérénol pour stimuler l'internalisation des récepteurs, qui est visualisée par la ß-arrestine marquée à la GFP (vert). Les cellules ont été contre-colorées avec 33342 un colorant nucléaire Hoechst.
2. Contrôlez et maintenez des conditions environnementales appropriées lors de l’imagerie de vos échantillons
Il est important de maintenir des conditions environnementales appropriées pour vos échantillons tout au long de l’expérience d’imagerie des cellules vivantes. Les contrôles environnementaux comprennent la température, l’humidité et le gaz (c.-à-d. l’oxygène et le dioxyde de carbone).
La capacité à réguler et à préserver une température stable maintient non seulement la santé cellulaire, mais réduit également le risque de dérive de la mise au point. La dérive de la mise au point est l’incapacité à maintenir la mise au point dans le temps. Elle est généralement due à des variations de température, qui provoquent l’expansion et la contraction des matériaux utilisés pour fabriquer la microplaque ou d’autres récipients de culture. Pour réduire davantage le risque de dérive de la mise au point due aux fluctuations thermiques, assurez-vous que la microplaque est installée sur la platine de l’instrument ou dans la chambre de contrôle de l’environnement pour permettre l’équilibrage thermique avant de configurer les paramètres d’acquisition. En outre, si le milieu doit être ajouté aux puits pendant l’expérience séquentielle, s’assurer qu’il est à la même température que le milieu dans le récipient d’imagerie. Les options de contrôle du circuit hydraulique embarqué, ou l’intégration de l’automatisation avec les manipulateurs de liquides pour les ajouts de milieux et de réactifs, augmentent le débit et minimisent le risque de contamination ou de perturbation des cellules par une intervention manuelle.

Le maintien d’une humidité adéquate permet d’éviter l’évaporation du milieu, en particulier pour les expériences à long terme sur cellules vivantes. L’évaporation entraîne des modifications de l’osmolarité qui peuvent avoir un impact négatif sur le comportement de vos cellules et affecter votre test. Une solution hypotonique (faible soluté) peut être utilisée si le contrôle de l’humidité n’est pas une option.
Il est également important de contrôler le taux de dioxyde de carbone, car il aide à réguler le pH de votre échantillon. Si vous n’êtes pas en mesure de contrôler les niveaux de dioxyde de carbone, il existe différents tampons synthétiques, tels que HEPES, qui peuvent être utilisés pour maintenir le pH. Cependant, la compatibilité entre les cellules d’intérêt et le tampon synthétique doit être vérifiée avant utilisation, car les tampons synthétiques peuvent être nocifs pour de nombreux types de cellules. Si les cellules sont compatibles, HEPES doit être utilisé pour des études à court terme qui durent quelques heures, car un entretien prolongé dans un milieu tamponné HEPES pourrait être nocif pour les cellules.
Il est également essentiel de maintenir des niveaux d’oxygène adéquats, car les besoins en oxygène peuvent varier considérablement en fonction du type de cellule ou des exigences de l’expérience sur cellules vivantes.
Les imageurs tels que le système d’imagerie cellulaire automatisé ImageXpress® Pico et le système d’imagerie à haut contenu ImageXpress® Confocal HT.ai incluent diverses options de contrôle de l’environnement pour la température, l’humidité, l’oxygène et le dioxyde de carbone. Comme ces imageurs peuvent être totalement intégrés à un système de contrôle de l’environnement fermé, les plaques ne sont pas exposées à la lumière ambiante et à d’autres conditions de laboratoire externes qui pourraient compromettre l’intégrité de l’échantillon. De plus, le logiciel du système ImageXpress vous permet de surveiller avec précision l’environnement cellulaire au cours de l’expérience grâce à des lectures de capteurs de contrôle de l’environnement.
3. Utiliser des modes autofocus robustes pendant l’acquisition d’images
Nos systèmes ImageXpress sont conçus avec une variété de modes d’autofocus matériel (laser et LED) et logiciel (basé sur l’image) qui vous permettent de trouver et de conserver des images de mise au point entre les expériences et de minimiser la dérive de la mise au point. Les modes autofocus peuvent s’adapter à un large éventail d’échantillons, d’épaisseurs de récipients de culture, d’objectifs et de paramètres d’imagerie.
Les méthodes d’autofocus matériel fonctionnent pour la plupart des échantillons et sont indépendantes de la qualité et de la luminosité de l’échantillon. L’autofocus matériel permet des vitesses d’acquisition plus rapides, minimisant ainsi le photoblanchiment des échantillons. Lorsque la position Z de l’échantillon varie dans le temps ou sur une plaque, l’ajout de méthodes d’autofocus logiciel peut aider à fournir une mise au point fiable sur l’ensemble de l’échantillon et du matériel de laboratoire. Dans la plupart des cas où une mise au point logicielle est nécessaire, l’autofocus matériel et logiciel doit être activé. L’autofocus matériel trouvera les surfaces inférieure, inférieure ou les deux. Ensuite, l’autofocus du logiciel utilisera le contraste d’image pour trouver le plan focal idéal. Ainsi, les échantillons doivent être brillants et exempts de débris pour que l’autofocus du logiciel fonctionne de manière optimale.
Contrairement à l’autofocus matériel, l’autofocus logiciel diminue les vitesses d’acquisition et présente le risque de photoblanchiment des échantillons. Pour réduire cela, l’autofocus logiciel doit être activé pour le premier canal acquis, et la lumière transmise peut être utilisée comme ce premier canal au lieu d’un canal fluorescent. De plus, réduisez votre temps d’exposition et utilisez des fluorophores plus brillants et plus stables. Des outils tels que le binning (voir n° 6) peuvent également être utilisés pour réduire les temps d’exposition.
Les méthodes d’autofocus logiciel ne doivent être utilisées seules que lorsque l’autofocus matériel n’a pas été configuré pour votre plaque, lorsque l’autofocus matériel échoue en raison d’imperfections de la plaque, lorsque le faible volume dans les puits diminue la fiabilité de l’autofocus matériel ou lorsque des objectifs à immersion dans l’huile sont utilisés.
Le logiciel d’acquisition et d’analyse d’images haut contenu MetaXpress® permet aux utilisateurs de configurer les paramètres d’autofocus pour répondre aux besoins d’un test particulier. Lors de la réalisation d’expériences séquentielles à cinétique rapide dans un seul puits, l’autofocus peut être appliqué au premier point temporel uniquement pour augmenter le taux d’acquisition. Pour les expériences séquentielles à long terme ou lorsque la fréquence d’imagerie n’est pas critique, l’autofocus peut être réglé sur tous les points temporels pour réduire la dérive de la mise au point.
Dans le logiciel d’acquisition et d’analyse d’images CellReporterXpress®, un grand nombre de routines d’autofocus matériel et logiciel peuvent être activées. Chacun est conçu pour des cas d’utilisation spécifiques, offrant des options de mise au point inégalées pour un grand nombre d’échantillons. Par exemple, la routine d’autofocus matériel de l’insert de puits détecte trois pics (fond de la plaque, fond du puits et insert de puits) pour une détection rapide et une mise au point optimale pour les appareils de laboratoire qui contiennent trois surfaces distinctes. Pour les acquisitions qui nécessitent une vitesse accrue avec un faible grossissement, la routine Position de mise au point d’ancrage conserve la position Z sélectionnée dans la mise au point, désactive l’autofocus et fait l’acquisition d’images avec cette position de mise au point enregistrée. Ceci est particulièrement utile pour travailler avec des échantillons macroscopiques comme des organismes entiers ou des tissus.
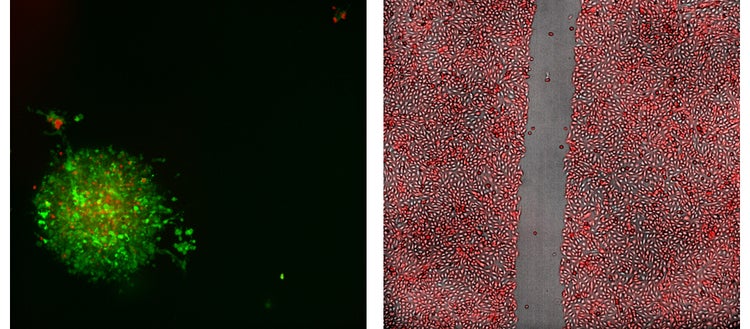
À gauche : Image de projection 2D confocale 20X représentative d’un test d’immuno-oncologie montrant un sphéroïde de cancer du côlon de souris ; fabriquée à partir de cellules MC38 exprimant la GFP, traitées avec des lymphocytes T exprimant la RFP.
À droite : Image du test de cicatrisation des plaies 4X des cellules Sigma U2OS qui ont été transfectées de manière stable pour exprimer la RFP.
4. Minimisez la puissance de la source lumineuse d’éclairage ainsi que le temps d’exposition pendant l’acquisition de l’image
La puissance de votre source lumineuse et le temps d’exposition peuvent provoquer une phototoxicité de vos cellules. Même de petites modifications des cellules peuvent affecter leur comportement ou l’expression des gènes. Vous devez donc trouver le bon équilibre, où vous pouvez acquérir une image de qualité sans exposer votre échantillon à trop de lumière.
En termes d’éclairage, lorsqu’un fluorophore ou une molécule fluorescente est mis à l’état de sortie, il génère des radicaux libres qui peuvent endommager l’ADN et exercer un stress sur les cellules. Plus l’intensité de la lumière est élevée, plus l’état d’excitation est élevé, ce qui peut entraîner une phototoxicité ou des dommages aux cellules. La lumière ultraviolette (UV) est connue pour être plus phototoxique, donc l’utilisation de fluorophores excitables tels que le DAPI peut produire plus de phototoxicité, par rapport à l’utilisation de fluorophores verts ou rouges.
En ce qui concerne l’imagerie par fluorescence ou l’imagerie multi-couleurs, il est préférable d’utiliser des fluorophores photographiques et très lumineux, à rapport signal/bruit élevé, avec des pics d’émission distincts. Cela vous permet de réduire votre temps d’exposition. Le système ImageXpress comprend des cubes de filtre passe-bande étroit pour éliminer la diaphonie. Il comprend également des sources de lumière haute puissance qui peuvent être atténuées et contrôlées. Le système ImageXpress Confocal HT.ai, par exemple, comprend une source de lumière laser à 7 canaux avec huit canaux d’imagerie pour s’adapter aux expériences de marquage multicolore, comme les applications de marquage cellulaire.
Les objectifs à grande ouverture numérique (NA), tels que les objectifs à immersion dans l’eau, vous permettent de générer des images haute résolution plus lumineuses avec des temps d’exposition plus faibles. Lorsque vous utilisez des objectifs à AN élevé, il est préférable d’utiliser des microplaques en plastique minces ou des boîtes de culture (c.-à-d. celles qui ont l’épaisseur d’un couvre-objet). L’utilisation de microplaques à fond clair et paroi noire est également préférable, car elles génèrent moins d’autofluorescence.
5. Le cas échéant, utilisez des algorithmes de déconvolution d’images lorsque vous utilisez des systèmes de microscopie à large champ
Les systèmes de microscopie à large champ, tels que le système ImageXpress Pico et le système d’imagerie à haut contenu ImageXpress® Micro Confocal sont optimaux pour réaliser des expériences d’imagerie de cellules vivantes. Pour augmenter la résolution ou la sensibilité avec ces systèmes, des algorithmes de déconvolution d’images peuvent être utilisés. Le logiciel de déconvolution d’image réduit la lumière floue pendant l’acquisition, ce qui vous permet de réduire les temps d’exposition et de maintenir la qualité du test. Cependant, la déconvolution doit être appliquée avec précision et précaution afin de ne pas générer d’artefacts.
6. Utilisez des systèmes d’imagerie confocale qui permettent l’utilisation de sources de lumière laser haute puissance et de binning
Les systèmes de microscopie confocale tels que le système ImageXpress Confocal HT.ai comprennent des sources de lumière laser qui sont mieux utilisées pour l’imagerie d’échantillons 3D, d’échantillons épais ou de fluorophores sombres (par ex., protéines marquées par fluorescence). Les instruments confocal vous permettent de réguler et de contrôler la puissance d’intensité de la lumière laser et LED.
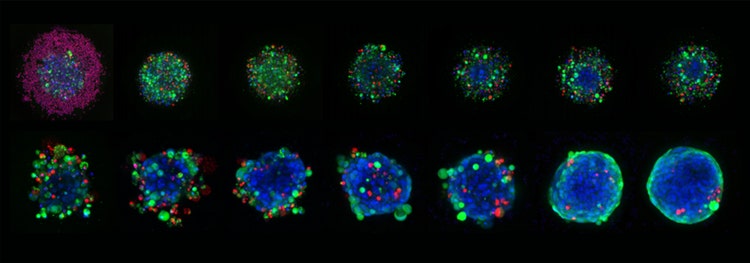
Images représentatives 10X Plan Apo de sphéroïdes HCT116 cultivés dans des microplaques de microcavité Corning Elplasia et traités avec des concentrations variables de staurosporine pendant six jours au total. Les sphéroïdes ont été marqués avec Hoechst 33342 (bleu, noyaux), la calcéine AM (verte, cellules vivantes) et l’éthidium homodimer-III (globules rouges, morts).
Le binning est un autre outil qui peut être utilisé lors de l’imagerie à large champ ou confocale, mais les effets du binning sont plus évidents lors de l’imagerie avec des instruments confocales. Étant donné que la configuration à disque rotatif du système confocal limite la quantité de lumière qui frappe l’échantillon et bloque la lumière floue, vous devez généralement utiliser des temps d’exposition plus élevés ou une lumière d’intensité plus élevée. Le binning réduit la nécessité de le faire en combinant la charge électrique ou le signal d’intensité des pixels adjacents et en générant une somme des intensités de pixels dans une certaine région. Ce résumé vous donne une intensité plus élevée. Le binning augmente essentiellement le signal au bruit dans l’image, ce qui vous permet d’utiliser un temps d’exposition plus faible et une intensité lumineuse plus faible. Cela diminue cependant la résolution spatiale. Là encore, il s’agit de trouver l’équilibre entre l’acquisition d’une image de qualité et le maintien de la santé de votre échantillon.
7. Utilisez un logiciel d’analyse puissant pour obtenir des données reproductibles et significatives
Les applications d’imagerie de cellules vivantes nécessitent la capacité d’extraire de grandes quantités de données quantitatives à partir d’images et d’ensembles de données volumineux et parfois complexes.
Les solutions d’analyse haut contenu (HCA) comme notre logiciel MetaXpress et CellReporterXpress® incluent des algorithmes d’analyse robustes pour segmenter avec précision les images et générer des données reproductibles. Ils comprennent des modules d’analyse préconfigurés pour un grand nombre d’applications d’imagerie de cellules vivantes. Une analyse plus personnalisée peut être réalisée à l’aide de l’éditeur de modules client dans le logiciel MetaXpress.
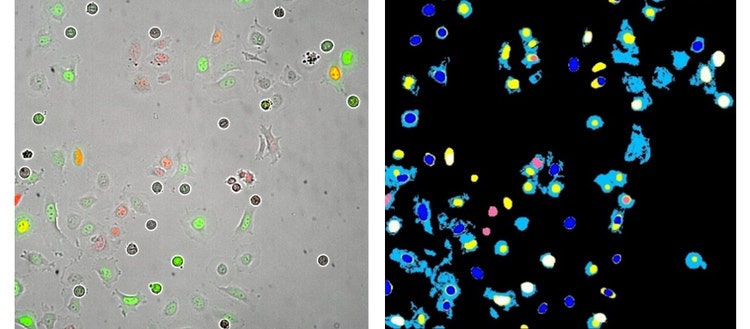
À gauche : Image 20X Plan Apo de cellules HeLa transfectées avec les capteurs Fucci Cell Cycle (GFP -geminine et RFP-Cdt-1). Cette image a été prise 13 heures après le traitement avec l’inhibiteur du cycle cellulaire noccodazole.
À droite : Masques de segmentation d’analyse générés à partir d’une analyse de module personnalisé MetaXpress.
Si vous souhaitez obtenir des informations plus approfondies sur les cellules étudiées, vous pouvez utiliser des algorithmes d’apprentissage machine dotés de capacités avancées d’analyse des données. Notre progiciel d’analyse d’images IN Cartaκ contient des flux de travail guidés d’apprentissage machine pour améliorer la précision de l’analyse et trier et comparer de grandes quantités de données d’imagerie hétérogène.
Comme les expériences d’imagerie de cellules vivantes génèrent beaucoup de données, il est essentiel d’avoir une capacité de stockage adéquate ainsi qu’une puissance de traitement pour l’analyse des données. Comme indiqué précédemment, le binning peut réduire la taille des données de l’image et permettre un transfert des données plus rapide afin que les images puissent être analysées plus rapidement. Le système ImageXpress comprend également le logiciel d’analyse d’images distribuée haut contenu MetaXpress® PowerCoreκ qui utilise le traitement parallèle pour augmenter considérablement la vitesse d’analyse.
Pour en savoir plus sur les diverses applications et techniques utilisées pour l’imagerie de cellules vivantes, consultez notre page Imagerie de cellules vivantes.