Science des cellules souches et médecine régénérative – Technologie et méthodes présentées à l’ISSCR 2022
Ce fut une nouvelle année formidable à l’ISSCR 2022 ! Des leaders du monde entier se sont réunis pour discuter des nouvelles technologies, partager leurs idées et explorer les dernières avancées dans le domaine de la science des cellules souches et de la médecine régénérative. En outre, les participants ont découvert des solutions automatisées et quantifiables pour les complexités associées aux tests de modèle cellulaire 3D.
Si vous avez manqué le spectacle ou si vous souhaitez plus de détails sur la technologie et les méthodes présentées, nous avons ce qu’il vous faut !
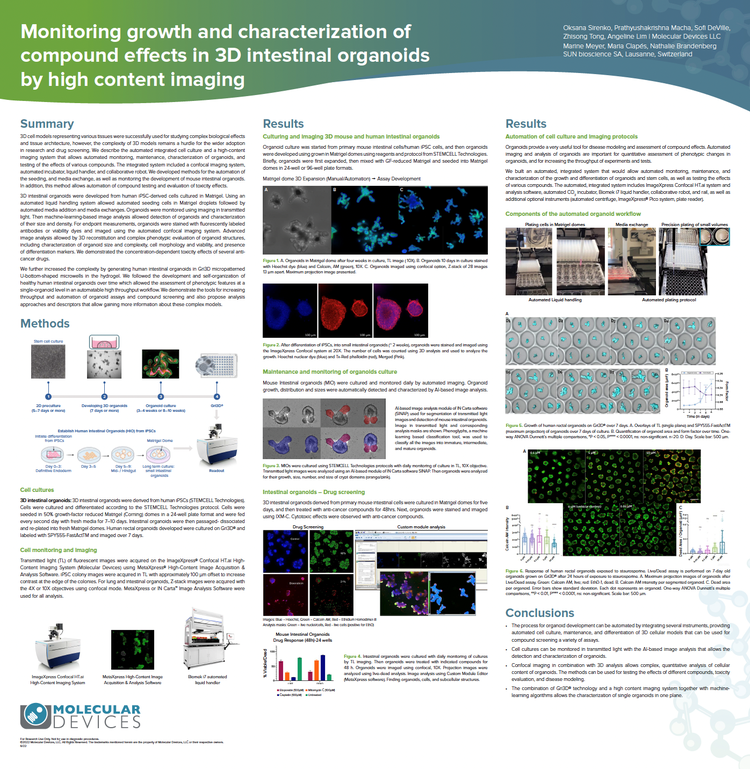
Surveillance de la croissance et caractérisation des effets des composés dans les organoïdes intestinaux 3D grâce à l’imagerie haut contenu
Nous avons développé des méthodes pour l’automatisation des cellules d’ensemencement dans Matrigel et l’échange de milieux, ainsi que pour le suivi du développement d’organoïdes intestinaux de souris par imagerie en lumière transmise. L’analyse d’images basée sur l’apprentissage machine a permis la détection des organoïdes et la caractérisation de leur taille et de leur densité. L’analyse d’images avancée a permis la reconstitution 3D et l’évaluation phénotypique complexe des structures des organoïdes, notamment la caractérisation de la taille et de la complexité des organoïdes, la morphologie et la viabilité cellulaires, ainsi que la présence de marqueurs de différenciation. Nous démontrons les effets de toxicité dépendants de la concentration de plusieurs médicaments anticancéreux.
Nous avons encore augmenté la complexité en générant des organoïdes intestinaux humains dans des micropuits en forme de U micropatternés Gri3D® dans l’hydrogel. Nous démontrons les outils permettant d’augmenter le débit et l’automatisation des tests d’organoïdes et du criblage des composés et proposons des approches d’analyse et des descripteurs qui fournissent plus d’informations sur ces modèles complexes.
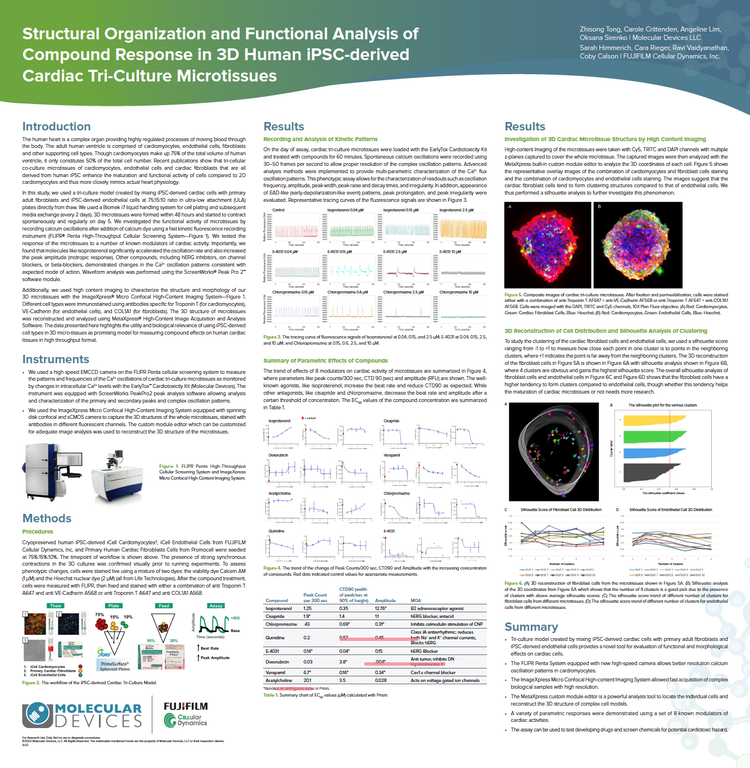
Organisation structurelle et analyse fonctionnelle de la réponse des composés dans des micro-tissus tri-culturels dérivés d’iPSC humaines 3D
Dans cette étude, nous avons utilisé un modèle de triculture créé en mélangeant des cellules cardiaques dérivées d’iPSC avec des fibroblastes primaires adultes et des cellules endothéliales dérivées d’iPSC. Nous avons utilisé un système de manipulation de liquides Biomek i7 pour le placage des cellules et le remplacement ultérieur des milieux. Nous avons étudié l’activité fonctionnelle des micro-tissus en enregistrant les oscillations du calcium à l’aide d’un instrument d’enregistrement de fluorescence cinétique rapide, le système de criblage cellulaire à haut débit FLIPR® Penta, tandis que l’analyse des ondes a été réalisée à l’aide du module logiciel ScreenWorks®2 Peak Pro κ. De plus, nous avons utilisé l’imagerie haut contenu pour caractériser la structure et la morphologie de nos micro-tissus 3D avec le système d’imagerie haut contenu ImageXpress® Micro Confocal. La structure 3D des micro-tissus a été reconstruite et analysée à l’aide du logiciel d’acquisition et d’analyse d’images haut contenu MetaXpress®.
Les données présentées ici soulignent l’utilité et la pertinence biologique de l’utilisation de types de cellules dérivées d’iPSC dans les micro-tissus 3D comme modèle prometteur pour mesurer les effets des composés sur les tissus cardiaques humains dans un format haut débit.
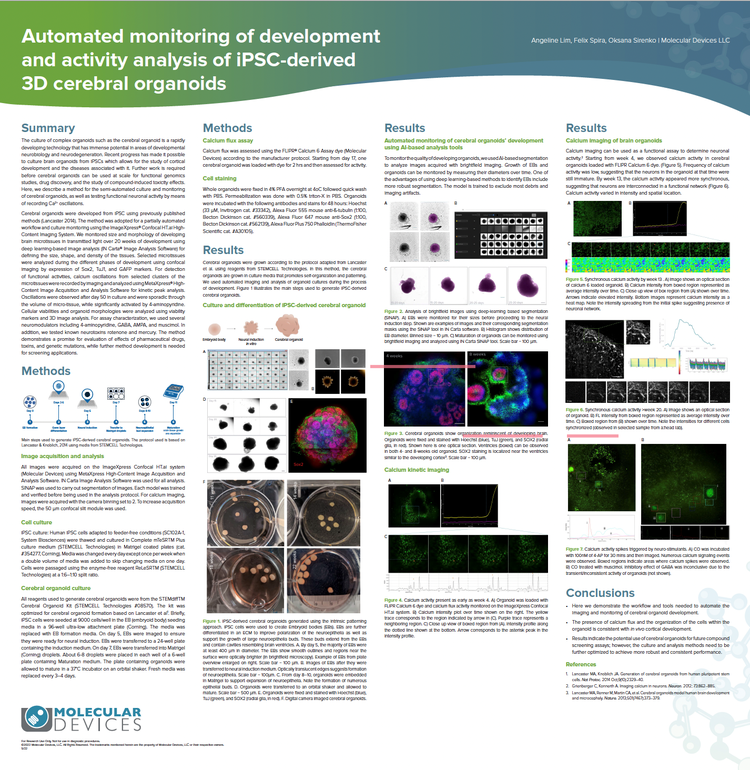
Suivi automatisé du développement et de l’activité des organoïdes cérébraux 3D dérivés d’iPSC et analyse de leur activité
Les organoïdes cérébraux ont été développés à partir d’iPSC en utilisant des méthodes précédemment publiées (Lancaster 2014). La méthode a été adoptée pour un flux de travail partiellement automatisé et la surveillance de la culture à l’aide du système d’imagerie haut contenu ImageXpress Confocal HT.ai . Nous avons surveillé la taille et la morphologie du développement de micro-tissus cérébraux en lumière transmise au cours de 20 semaines de développement en utilisant l’analyse d’images basée sur l’apprentissage profond (logiciel d’analyse d’imagesIN Carta® ) pour définir la taille, la forme et la densité des tissus. Pour la détection des activités fonctionnelles, les oscillations du calcium à partir de groupes sélectionnés de micro-tissus ont été enregistrées par imagerie et analysées en utilisant l’acquisition d’images haut contenu et l’analyse MetaXpress Softwar e pour l’analyse des pics cinétiques.
La méthode est prometteuse pour l’évaluation des effets des médicaments pharmaceutiques, des toxines et des mutations génétiques, tandis que le développement de méthodes supplémentaires est nécessaire pour les applications de criblage.
Jetez un œil à l’endroit où se déroulent nos recherches !
Découvrez notre Centre d’innovation des organoïdes où nous présentons des instruments de pointe qui fonctionnent ensemble de manière harmonieuse pour la croissance et le suivi de cultures cellulaires 2D et 3D de cellules vivantes autonomes et à long terme grâce à l’imagerie intelligente sans marquage. Ce flux de travail intégré fournit des alertes de contrôle qualité et de préparation, le criblage d’organoïdes 3D et l’analyse d’images en apprentissage profond qui révèle les modèles cachés que d’autres technologies passent à côté.