
Exploitation des tests sur microplaques pour le criblage de médicaments à haut débit rationalisé dans la recherche sur le cancer
Sommaire
- Criblage haut débit dans la recherche sur le cancer
- Tests sur microplaques pour la recherche sur le cancer
- Libérez le potentiel des lecteurs de microplaques dans la recherche sur le cancer
Criblage haut débit dans la recherche sur le cancer
Le criblage haut débit (HTS) a révolutionné le domaine de la recherche sur le cancer en permettant l’évaluation rapide et systématique des composés pour leur potentiel en tant qu’agents anticancéreux. Cette approche constitue une étape essentielle dans les premiers stades de la découverte de médicaments contre le cancer.
Le HTS implique l’évaluation méthodique de milliers à millions de composés issus de banques afin d’identifier les candidats potentiels qui interagissent avec des cibles biologiques spécifiques de manière prévisible. Ces candidats, souvent appelés « chefs de file » ou « coups de cœur », servent de base à l’optimisation et au développement d’agents anticancéreux potentiels.
En outre, les avancées récentes dans le traitement personnalisé du cancer ont été stimulées par le développement de médicaments ciblés. Ces traitements peuvent tirer parti des innovations de la technologie des organoïdes, qui implique la culture d’organoïdes avec une capacité d’auto-renouvellement, une auto-organisation et une prolifération à long terme tout en imitant de nombreuses caractéristiques des tissus primaires. Les banques d’organoïdes dérivés de patients (PDO) sont devenues des biobanques vivantes, permettant des analyses approfondies de la fonction tissulaire, du développement, de l’initiation de la tumeur et de la pathobiologie du cancer. Les PDO sont polyvalents et peuvent être utilisés pour les analyses de séquençage, le criblage de médicaments, les tests de thérapie ciblée, les études de micro-environnement tumoral et les applications d’ingénierie génétique.
Dans le domaine de la recherche sur le cancer, ces instruments sont généralement utilisés pour évaluer les effets des composés sur les lignées cellulaires cancéreuses, étudier l’expression de gènes ou de protéines spécifiques et évaluer diverses réponses cellulaires. Ils jouent un rôle essentiel dans l’identification des agents anticancéreux potentiels et l’avancement de notre compréhension de la biologie du cancer grâce à des efforts de criblage systématique à grande échelle.
La robotique et les dispositifs de manipulation des liquides sont essentiels pour l’automatisation du HTS. Ces technologies permettent la distribution précise de composés, de cellules et de réactifs dans des plaques multi-puits, garantissant ainsi la cohérence et minimisant les erreurs humaines.
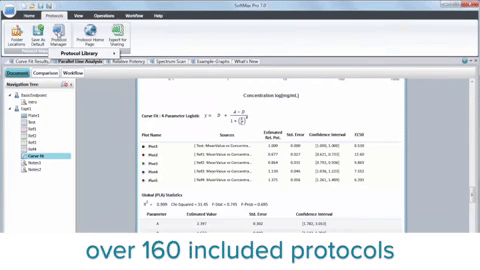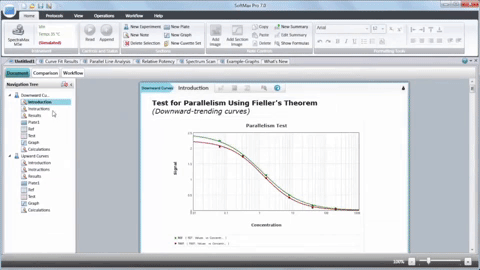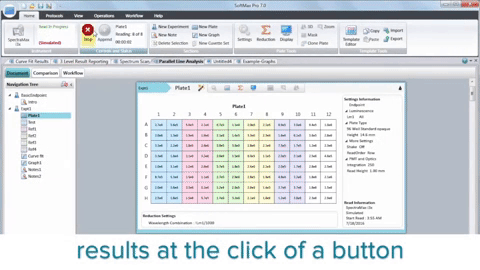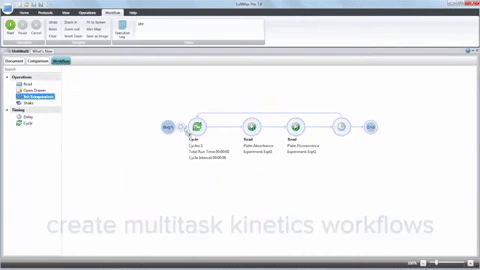
En résumé, l’intégration des lecteurs de microplaques, de la biologie 3D, de la robotique, des dispositifs de manipulation des liquides et des logiciels dédiés a révolutionné la recherche sur le cancer en accélérant la découverte de composés anticancéreux potentiels. Bien que le HTS ne remplace pas l’ensemble du processus de découverte de médicaments, il joue un rôle essentiel dans l’identification des chefs de file et améliore notre compréhension de la biologie du cancer.
Tests sur microplaques pour la recherche sur le cancer
Les tests sur microplaques sont devenus des outils précieux, offrant des capacités haut débit et la possibilité d’analyser simultanément de nombreux échantillons. Ces tests permettent aux chercheurs d’étudier divers aspects de la biologie du cancer, de la viabilité cellulaire et de la cytotoxicité aux interactions protéine-protéine et à l’activité enzymatique. Dans cet article, nous allons découvrir certains des principaux tests sur microplaques utilisés dans la recherche sur le cancer :
tests de viabilité cellulaire
Les tests de viabilité cellulaire sont utilisés pour déterminer le nombre de cellules viables et en prolifération dans un échantillon. Ils sont essentiels pour évaluer l’impact des différents traitements sur les cellules cancéreuses, ce qui aide les chercheurs à évaluer le potentiel des agents anticancéreux. Les méthodes courantes incluent l’utilisation de colorants qui sont absorbés par des cellules vivantes, et le signal qui en résulte est mesuré par un lecteur de microplaques.
- Le test MTT (3-(4,5-diméthylthiazol-2-yl)-2,5-diphényltétrazolium bromide) est largement utilisé dans la recherche pour évaluer la viabilité et la prolifération cellulaires avec des lectures colorimétriques. Le colorant jaune MTT est réduit par les cellules métaboliquement actives pour former un produit formazan violet (Figure 1). Il est solubilisé et l’intensité de l’absorbance est mesurée sur un lecteur de microplaques à 590 nm. Le MTT est relativement peu coûteux et relativement rapide, car il peut donner des résultats en quatre heures. Sur le marché, il existe d’autres tests sur microplaques qui fonctionnent de la même manière, par exemple le XTT jaune (2,3-bis-(2-méthoxy-4-nitro-5-sulfophényl)-2H-tétrazolium-5-carboxanilide) est réduit par les cellules métaboliquement actives en formazan orange (lecture par absorbance, OD 450-500 nm) ou le colorant à base de resazurine (alamarBlue) est réduit en résorufine (lecture par fluorescence, ex 560 / em 590).
Lire la note d’application : Évaluez la viabilité et la prolifération cellulaires avec des lectures colorimétriques

Figure 1. Schéma du mécanisme du test MTT
- Le test ATP (adénosine triphosphate) est un test de luminescence homogène et stable permettant de déterminer le nombre de cellules viables en culture. La méthode est basée sur la quantification de l’ATP présent dans le puits, un indicateur des cellules métaboliquement actives (Figure 2). Plusieurs entreprises vendent des composés prêts à l'emploi qui doivent être ajoutés à 1 :1 dans le puits avec les échantillons, et après une incubation très courte, l'échantillon peut être lu sur un lecteur de microplaques équipé d'un mode de détection par luminescence. Comme indiqué ci-dessus, plusieurs tests de recherche sur le cancer sont réalisés sur des modèles 3D. Il peut être difficile de réaliser un test de viabilité sur des sphéroïdes en raison de la difficulté à s’assurer que le réactif atteint l’âme centrale du sphéroïde. Néanmoins, des tests de viabilité basés sur l’ATP spécifiques aux cultures 3D sont désormais disponibles, ce qui facilite l’évaluation rapide de la réponse au médicament dans les systèmes modèles 2D et 3D.
En savoir plus sur les tests ATP :

Figure 2. Schéma du mécanisme de test de la luciférine à base d’ATP
- Le test EarlyToxκ Live/Dead de Molecular Devices contient deux marqueurs pour les cellules vivantes ou mortes : calcéine AM et éthidium homodimer-III (EthD-III). La calcéine AM non fluorescente traverse la membrane cellulaire intacte puis est convertie en calcéine fluorescente par les estérases intracellulaires. À l'inverse de la calcéine AM, l’EthD-III ne peut pas traverser la membrane plasmatique intacte et reste donc sous forme non fluorescente. Lorsque l’intégrité de la membrane cellulaire est compromise (par la mort cellulaire), l’EthD-III pénètre dans les cellules et se lie aux acides nucléiques, entraînant une fluorescence rouge vive dans les cellules mortes (Figure 4).
Lire la note d’application : Détermination de la santé des cellules par des tests de viabilité cellulaire utilisant le lecteur SpectraMax iD3
tests de cytotoxicité
Dans la recherche sur le cancer, il est essentiel de comprendre comment les cellules répondent à divers traitements, y compris aux agents anticancéreux potentiels. Ces tests sur microplaques peuvent aider les chercheurs à faire la distinction entre les processus apoptotiques (mort cellulaire programmée) et nécrotiques (mort cellulaire non contrôlée).
- Divers tests ont été conçus pour détecter et mesurer différents processus de mort cellulaire, notamment l’apoptose et la nécrose. Dans l’un de ces tests de Promega, la liaison de deux protéines de fusion de l’annexine V contenant des sous-unités complémentaires de luciférase NanoBiT® à la phosphatidylsérine exposée sur la feuillet externe des membranes cellulaires pendant le processus apoptotique permet de générer un signal luminescent. En cas de perte d’intégrité de la membrane, un colorant de liaison à l’ADN pénètre dans la cellule et génère un signal fluorescent vert (Figure 3).

Figure 3. Dans les cellules saines, les protéines de fusion Annexin V-LgBiT et Annexin V-SmBiT (NanoBiT) sont très séparées et aucune luminescence n’est générée. Le colorant de l’ADN profluorescent ne se lie pas à l’ADN, et le signal fluorescent est également absent (A). Dans l’apoptose précoce, la luminescence reste faible jusqu’à ce que l’exposition au PS rapproche les protéines de fusion Annexeine V, formant une luciférase fonctionnelle, tandis que le colorant de l’ADN profluorescent reste en dehors des cellules. La luminescence est générée et la fluorescence reste absente (B). Pendant la nécrose secondaire, un signal fluorescent est généré lors de la perte d’intégrité de la membrane pendant l’apoptose au stade avancé, lorsque le colorant d’ADN peut pénétrer dans la cellule. La luminescence et la fluorescence sont générées dans ce cas (C).
- Dans le test LDH (Lactate Déshydrogénase), la LDH est libérée dans le milieu de culture cellulaire lorsque les membranes cellulaires sont interrompues, comme dans le cas de cellules mortes ou mourantes.
- L’activité des caspases est mesurée à l’aide d’un substrat fluorogène qui émet une fluorescence lors du clivage par les caspases actives. En savoir plus sur le test homogène en une seule étape Caspase-3, spécialement conçu pour les lecteurs de microplaques : Le substrat fluorogène (Ac-DEVD)2-R110 contient deux séquences DEVD consensus cibles et est entièrement hydrolysé dans le lysat cellulaire par ces enzymes. L’hydrolyse des deux peptides DEVD libère le colorant vert fluorescent R110, entraînant une augmentation significative de la fluorescence, avec une excitation à 110 nm et une émission à nm. Les kits de test EarlyTox Caspase-3/7 NucView permettent de détecter l’apoptose dans des populations de cellules intactes en utilisant le substrat NucView Caspase-3. L’avantage de ce test sur microplaque est qu’il a été optimisé pour une utilisation avec les lecteurs de microplaques et les systèmes d’imagerie. Ce kit de test, utilisé avec les lecteurs de microplaques SpectraMax ou le cytomètre d’300imagerie SpectraMax MiniMax , offre aux utilisateurs une approche flexible de la quantification de l’apoptose. Les cellules apoptotiques peuvent être mesurées directement en fonction de la fluorescence totale par puits, ou par imagerie et comptage de cellules individuelles, avec des résultats comparables pour les deux méthodes. Enfin, nous avons montré que le 488 test EarlyTox Caspase-3/7 NucViewκ fonctionne également très bien sur les sphéroïdes. Plus précisément, nous avons évalué l’apoptose dans des sphéroïdes HepG2 magnétiquement bioimprimés (Figure 4).

Figure 4. Schéma des différentes options qui peuvent être recherchées lors de la réalisation d'études de toxicité avec les kits de viabilité cellulaire EarlyTox .
Essais par gènes rapporteurs
Ces tests sur microplaques impliquent l’introduction de gènes rapporteurs dans le cancer ou d’autres types de cellules pour surveiller l’activité de gènes spécifiques ou de voies de signalisation. L’expression du gène rapporteur peut être quantifiée à l’aide de lecteurs de microplaques, fournissant des informations sur la régulation des gènes et voies liés au cancer. L’un des tests les plus largement utilisés est le dosage des rapporteurs de luciférase, qui permet d’étudier l’expression des gènes au niveau transcriptionnel. Il est populaire car il est relativement peu coûteux et donne des mesures quantitatives rapides. La luciférase Firefly est un rapporteur largement utilisé pour étudier la régulation et la fonction des gènes. Il s’agit d’un rapporteur très sensible en raison de l’activité endogène insuffisante de la luciférase dans les cellules de mammifère… La luciférine Firefly catalyse l’oxydation ATP-dépendante de la D-luciférine avec l’émission de lumière qui en résulte (Figure 1A). La luciférase issue de la pansy Renilla reniformis est souvent utilisée dans les tests multiplexés de luciférase comme second rapporteur pour normaliser l’efficacité de la transfection et pour étudier la régulation et la fonction des gènes. La luciférase de rénilla catalyse l’oxydation de la coelentérazine pour produire de la lumière. Les tests de luciférase double permettent la mesure de l’activité de la luciférase Firefly et Renilla dans un seul échantillon, Firefly agissant comme rapporteur expérimental et Renilla comme témoin (Figure 5).

Figure 5. Réactions chimiques catalysées par la luciférase de luciole (A) et la luciférase de Renilla (B).
Le kit de test de gène rapporteur SpectraMax® DuoLuc™ permet une quantification extrêmement sensible à la fois des luciférases de luciole et de rénilla dans les cellules de mammifères. L'injection en série de deux réactifs de détection optimisés permet de tester les luciférases dans le même puits de microplaque. Nous montrons comment le dosage du gène rapporteur DuoLuc et le lecteur SpectraMax iD5 sont utilisés pour détecter l'activation du facteur nucléaire-κB (NF-κB) dans un modèle de cellule de mammifère. Le NF-κB est très important pour la régulation de l’inflammation, de l’immunité, de la prolifération, de la différenciation et de l’apoptose.
En savoir plus sur le test gène rapporteur double luciférase :
- Surveillez l’activation NF-κB au moyen d’un test à gène rapporteur Dual-Luciferase sensible sur le SpectraMax iD5
- Détectez l'expression de la dual luciférase sur le lecteur de microplaques FlexStation 3
Tests d’activité enzymatique
Les enzymes, telles que les kinases et les phosphatases, jouent un rôle essentiel dans les voies de signalisation du cancer. Les tests d’activité enzymatique impliquent la mesure de l’activité de ces enzymes en utilisant des substrats qui produisent un signal détectable. Les lecteurs de microplaques quantifient la réaction enzymatique, ce qui permet aux chercheurs d’évaluer l’impact des différents traitements sur l’activité enzymatique.
- La technologie IMAP® de MOLECULAR DEVICES permet un test non radioactif, homogène et rapide des kinases, des phosphatases et des phosphodiestérases, et convient au développement de tests et au criblage haut débit. Les tests IMAP se basent sur la liaison du phosphate à des complexes de coordination métalliques immobilisés sur des nanoparticules. Lorsque les entités de liaison IMAP se lient à un substrat phosphorylé, le mouvement moléculaire du peptide est altéré, et la polarisation de fluorescence (PF) pour le marquage fluorescent lié au peptide augmente (Figure 1, à gauche). Dans une version TR-FRET du test, l’inclusion d’un donneur de Terbium (Tb) permet qu’il se produise un transfert d’énergie fluorescente lorsqu’un substrat phosphorylé est présent (Figure 1, à droite). Ce test est détecté dans un mode en temps résolu, ce qui élimine pratiquement l’interférence de la fluorescence des composants du test ou des composés dans un criblage. TR-FRET offre également une certaine flexibilité au niveau de la concentration et de la taille du substrat.
En savoir plus sur les tests IMAP :

Figure 6. Principe des tests de phosphodiestérase IMAP PF et TR-FRET
- THUNDERκ est une plateforme de test cellulaire polyvalente et économique développée par Bioauxilium Research pour mesurer les protéines endogènes totales et phosphorylées individuelles. Plus précisément, le kit de test THUNDERκ Phospho-ERK1/2 (T202/Y204) est un immunoessai sandwich TR-FRET homogène avec un flux de travail simple composé de trois étapes qui peuvent indirectement rapporter l’activité supérieure ou inférieure du récepteur de tyrosine kinase, situé en amont de la voie de signalisation cellulaire MAPK/ERK (Figure 8).
Lire la note d’application : Mesure cellulaire de la phosphorylation d’ERK1/2 avec le test THUNDER TR-FRET

Figure Test immunologique en sandwich 8 THUNDER TR-FRET. La liaison de l’Eu-Ab1 et du FR-Ab2 à l’analyte permet un transfert d’énergie du chélate d’europium au fluorophore d’acceptation, ce qui donne un signal à 665 nm qui est détecté à l’aide d’un lecteur de microplaques avec un mode de détection en temps résolu.
Tests d’interaction protéine/protéine
Les chercheurs utilisent des lecteurs de microplaques pour détecter et quantifier les interactions entre des protéines spécifiques dans les voies cancéreuses. Ces interactions peuvent révéler les rôles de ces protéines dans le développement et la progression du cancer. Les traitements médicamenteux sont souvent conçus dans le but de perturber certaines interactions protéine/protéine. Il est donc important d’avoir des tests sur microplaques qui facilitent l’étude des interactions entre des protéines spécifiques.
- Le BRET (transfert d'énergie par résonance de bioluminescence) est une technique de mesure des interactions protéine/protéine ou protéine/ligand qui implique l’interaction d’un donneur bioluminescent et d’un accepteur fluorescent. Lorsque le donneur et l'accepteur sont proches de 10 nm, le donneur excite l'accepteur, qui émet ensuite une fluorescence. En marquant une protéine d'intérêt avec le donneur et son partenaire de liaison avec l'accepteur, on peut mesurer les interactions protéiques en utilisant un lecteur de microplaques pour détecter la lumière émise par le donneur et l'accepteur (Figure 9).
En savoir plus sur la technologie NanoBRET :

Figure 9. Test NanoBRET. Lorsqu’une fusion NanoLuc-Protéine A (donneur d’énergie) interagit avec une fusion HaloTag-Protéine B marquée par fluorescence (accepteur d’énergie), le donneur et l’accepteur sont rapprochés et l’énergie est transférée.
- Un grand nombre de kits et de réactifs de la boîte à outils sont disponibles pour les interactions protéine-protéine, les tests des récepteurs nucléaires, la dimérisation des récepteurs, la liaison du ligand, l’internalisation des récepteurs, les tests enzymatiques, et bien plus encore. Le HTRF implique l’utilisation de deux fluorophores, un donneur et un accepteur, pour marquer les protéines ou les autres biomolécules d’intérêt. Lorsque les biomolécules interagissent, leur proximité permet le transfert d’énergie par résonance de fluorescence (FRET) du fluorophore donneur vers le fluorophore accepteur. L’utilisation de cryptates de lanthanide fluorescents à vie comme donneurs permet la détection en temps résolu des tests HTRF, minimisant la fluorescence de fond brève des composés et autres matériaux. La détection du FRET en temps résolu (TR-FRET) avec un lecteur de microplaques permet une lecture de la liaison biomoléculaire. (Voir aussi IMAP TR-FRET, ci-dessus.)
- La polarisation de fluorescence (PF) est une technique très utilisée pour suivre les événements de liaison dans les solutions. Il peut être utilisé pour évaluer la liaison protéine-anticorps, l’hybridation de l’ADN, l’activité enzymatique, et il est bien adapté au criblage haut débit. Une petite molécule marquée par fluorescence (traceur) excitée avec une lumière polarisée dans un plan émet une lumière pratiquement dépolarisée, car le traceur chute rapidement entre l’excitation et l’émission. Toutefois, lorsque le traceur se lie à une molécule beaucoup plus grosse, il tourne plus lentement et la lumière émise reste très polarisée. La quantité de lumière polarisée/dépolarisée donnera une quantification de l’interaction entre la protéine et le traceur. (Voir aussi IMAP FP, ci-dessus.)
Lire la note d’application : Établir et optimiser un test de polarisation de fluorescence
ELISA (dosage d’immunoabsorption enzymatique)
Les tests ELISA sont largement utilisés pour la quantification des protéines dans la recherche sur le cancer. Les lecteurs de microplaques mesurent les signaux générés dans ces tests pour déterminer la concentration de protéines spécifiques, telles que les cytokines ou les facteurs de croissance, qui sont souvent pertinents pour la biologie du cancer
Pour en savoir plus sur les tests ELISA, téléchargez notre eBook, ELISA expliqué : des bases aux applications pratiques.
AlphaScreen/AlphaLISA
AlphaLisa est un test homogène basé sur des billes pour l’étude des interactions moléculaires dans un format de microplaque. Par rapport aux méthodes ELISA traditionnelles, qui comportent plusieurs étapes de lavage pouvant endommager les monocouches cellulaires et qui prennent beaucoup de temps, AlphaLISA ne nécessite pas d’étapes de lavage, minimisant ainsi la perte de cellules, ce qui permet d’obtenir des résultats plus rapides et plus précis.
Lire la note d’application : Écran AlphaLISA sur la plateforme de détection de microplaque multimode SpectraMax Paradigm
TR-FRET (y compris HTRF)
La technologie HTRF® est une technologie polyvalente développée par Cisbio pour détecter les interactions biomoléculaires. La HTRF®, technologie de dosage développée par Cisbio, associe le FRET standard, transfert d'énergie par résonance de type Förster, à la mesure de fluorescence en temps différé, ce qui résout le problème de la courte durée de la fluorescence en arrière-plan.
Lire la note d’application : Test HTRF Human TNFα sur le lecteur de microplaques multimode SpectraMax Paradigm
Le test utilise des fluorophores donneurs et accepteurs. Lorsque le donneur et l’accepteur sont suffisamment proches l’un de l’autre, l’excitation du donneur par une source d’énergie (p. ex., une lampe flash) déclenche un transfert d’énergie vers l’accepteur, qui à son tour émet une fluorescence spécifique à une longueur d’onde donnée. La HTRF est également largement utilisée pour remplacer les tests ELISA classiques, car elle offre une stratégie simple et sans lavage pour détecter et quantifier les protéines en seulement deux heures. De plus, il a une large plage de détection et il est évolutif avec une longue stabilité du signal.
Lire la note d’application : Normaliser les dosages des cytokines HTRF pour la viabilité cellulaire
Dérivés réactifs de l’oxygène (DRO)
Les DRO sont associés au stress oxydatif et au développement du cancer. Les lecteurs de microplaques peuvent quantifier les taux de DRO, ce qui aide les chercheurs à comprendre l’état oxydatif des cellules cancéreuses et la manière dont il peut contribuer à la progression du cancer.
Lire la note d’application : Mesure des dérivés réactifs de l'oxygène avec le lecteur de microplaques SpectraMax
Analyse du cycle cellulaire
L’analyse du cycle cellulaire est une étude importante souvent nécessaire dans la recherche sur le cancer. Elle est généralement réalisée par cytométrie en flux. Néanmoins, le lecteur de microplaques multimode SpectraMax® i3x équipé du cytomètre d'300imagerie SpectraMax® MiniMaxκ peut être utilisé pour l'imagerie et l'analyse d'images de sphéroïdes FUCCI (indicateur de cycle cellulaire par ubiquitination fluorescente). Les sphéroïdes FUCCI ont été développés pour étudier la progression du cycle des cellules cancéreuses, car ils permettent l’identification des cellules dans diverses phases du cycle cellulaire. La technologie FUCCI se base sur la surexpression des protéines dépendant du cycle cellulaire géminine et Cdt1, respectivement fusionnées à un fluorophore vert et à un fluorophore rouge. Les taux de Cdt1 et de géminine fluctuent de manière différentielle tout au long du cycle cellulaire : Les taux de Cdt1 culminent en phase G1, tandis que les taux de géminine augmentent en phase S, G2 et M tardive. Cela entraîne l’apparition d’un noyau de cellules exprimant FUCCI rouge dans la phase G1 et vert dans la phase S, G2 et M tardive (Figure 10). Bien que ce test ne soit pas indiqué pour les criblages HTS, il s’agit d’un test de microplaque important qui peut être mis en œuvre une fois que les pistes de composés ont été sélectionnées pour une caractérisation plus approfondie.
Lire la note d’application : Obtenez et analysez des images de sphéroïdes FUCCI sur le cytomètre SpectraMax MiniMax

Figure 10. Analyse du cycle cellulaire FUCCI. Les protéines mCherry-Cdt et AmCyan-geminin marquées par fluorescence sont exprimées ou dégradées pendant différentes phases du cycle cellulaire de sorte que les cellules apparaissent en rouge pendant la phase G1 et en vert pendant les phases S, G2 et M. L’imagerie cellulaire peut être utilisée pour surveiller le cycle cellulaire dans diverses conditions expérimentales.
Libérez le potentiel des lecteurs de microplaques dans la recherche sur le cancer
Malgré des avancées significatives dans la compréhension de la base moléculaire et cellulaire du cancer, il reste encore beaucoup à apprendre sur ses causes, sa progression et les traitements potentiels.
Nous avons conçu cet eBook pour vous fournir une vue d’ensemble complète du rôle des lecteurs de microplaques dans la recherche et le développement sur le cancer.
