
[Podcast] Difficultés du développement traditionnel de lignées cellulaires et technologies émergentes pour aider à réguler la monoclonalité
Les progrès en matière d’ingénierie génétique et de biologie de synthèse ont permis de nombreuses avancées au cours des dernières décennies. L’importance du développement de lignées cellulaires nécessite une mention honorable. Sans elle, de nombreux vaccins vitaux pour les maladies infectieuses, les médicaments à base d’anticorps et les produits à base de protéines recombinantes, y compris l’insuline, ne seraient pas largement disponibles. L’étape la plus difficile du développement de lignées cellulaires conformes est l’assurance de monoclonalité, principalement lorsqu’elle est réalisée manuellement. La monoclonalité des lignées cellulaires thérapeutiques doit être accomplie et documentée pour des raisons réglementaires.
Dans notre podcast « Développement de lignées cellulaires avec le Dr Natasa Skoko, ICGEB et le Dr Hugh Graham, MacroGenics », nous discutons des flux de travail traditionnels pour le développement de lignées cellulaires et des technologies émergentes pour aider à vérifier la monoclonalité.
Ici, nous avons résumé les principaux points de discussion des intervenants experts : Dr Natasa Skoko, chef de groupe de l’unité de développement biotechnologique au Centre international d’ingénierie génétique et de biotechnologie (ICGEB), et Dr Hugh Graham, directeur des sciences de la culture cellulaire chez MacroGenics.
Développement de lignées cellulaires
Assurance de monoclonalité
Technologies émergentes et impact réglementaire
Signification des lignées cellulaires stables
Dans la forme la plus simple, le terme lignée cellulaire définit une population de cellules qui peuvent être maintenues dans une culture pendant une certaine période et conserver un phénotype, une fonction et une stabilité distincts.
Le Dr Skoko résume la signification historique de la lignée cellulaire stable. « L’utilisation de la lignée cellulaire a fait la révolution, pas seulement dans la recherche scientifique, et a permis de comprendre de nombreux processus biologiques fondamentaux », ses applications vont de la production d’anticorps et de protéines thérapeutiques au criblage de médicaments.
Le développement de lignées cellulaires implique des cellules de mammifères techniques robustes, rentables et faciles à développer. Une lignée cellulaire qui répond à tous les critères est la cellule ovarienne de hamster chinois (CHO), développée pour la première fois en 1987. Aujourd’hui, 70% des agents biothérapeutiques sur le marché sont fabriqués à partir de lignées cellulaires CHO. Ils sont particulièrement efficaces dans la production de masse de biothérapeutiques, grâce à leur adaptabilité à divers milieux de croissance et conditions de croissance (par ex. suspension, croissance attachée, lot nourri, perfusion) ainsi qu’à leur capacité à plier et glycosyler les protéines pour imiter les modifications post-traductionnelles dans les protéines humaines.
Les défis d’un flux de travail traditionnel de développement de lignées cellulaires
La production de niveaux élevés de biothérapeutiques repose sur la génération de lignées cellulaires stables.
La première étape est la transfection d’une lignée cellulaire hôte appropriée avec le gène d’intérêt, conduisant à l’intégration aléatoire de l’ADN dans le génome hôte. Une fois que la lignée cellulaire modifiée commence à se développer, généralement sous pression de sélection, l’isolation de cellules uniques est nécessaire pour générer des clones pour le criblage.
Dans les flux de travail traditionnels, les cellules sont étalées sur une plaque 96à puits par dilution limitante. Cette méthode implique la dilution de la suspension cellulaire de sorte que lorsque vous étalez une certaine quantité dans un puits, la probabilité qu’elle n’ait qu’une cellule est très élevée. Certains puits peuvent même être vides et certains peuvent avoir plusieurs cellules. Par conséquent, vous avez une forte probabilité qu’une lignée cellulaire issue de l’un de ces puits soit développée à partir d’une cellule unique.
C’est génial, mais combien de temps cela prend-il ? En supposant que le nombre de cellules double toutes les 24 heures, il faut dix fois plus de cellules pour atteindre mille cellules, ce qui prendrait des 10 jours. Pour obtenir suffisamment de cellules avec lesquelles travailler, cela prendrait 2à3 semaines. En outre, les réglementations relatives à la monoclonalité exigent que vous répétiez la dilution limitante pour avoir une assurance supplémentaire de l’origine clonale de votre lignée cellulaire. Vous devrez donc passer des mois à obtenir des résultats grâce à cette méthode à faible débit. Le Dr Graham ajoute : « La stabilité de la lignée cellulaire est remise en question. Lorsque vous atteignez les chiffres souhaités et que vous avez une assurance élevée de monoclonalité, il est possible qu’ils aient dérivé de leurs propriétés, perdu certaines copies du gène d’intérêt ou se soient adaptés d’une manière que vous ne pensiez pas. »
Pour résumer, la dilution limitante peut ne pas parvenir à atteindre la vitesse, la conformité et la qualité des lignées cellulaires, car il est difficile de documenter la monoclonalité et de conserver la qualité de vos cellules. Le Dr Skoko et le Dr Graham conviennent tous deux que l’automatisation est la manière de faciliter la croissance de lignées cellulaires monoclonales à haut débit et sa documentation.
Fondamentaux de la lignée cellulaire monoclonale
Revenons maintenant en arrière pour définir la monoclonalité. Une lignée cellulaire monoclonale provient d’une cellule unique ou d’un progéniteur unique.
Pourquoi est-ce si important ? À mesure que les cellules commencent à se développer et à doubler, elles sont soumises à des dérives génétiques, à des mutations ou à la perte d’un plasmide. Il est donc presque impossible de s’assurer que la qualité des protéines thérapeutiques qu’elles expriment est uniforme en étudiant simplement leur phénotype le plus récent.
Pour compenser cela, vous devez commencer à documenter vos cellules le Jour Zéro pour prouver qu’elles proviennent bien d’une seule cellule.

La croissance cellulaire CHO-s a été utilisée pour capturer des images des plaques 6à puits à plusieurs points de mesure. Le Jour 0, on observe clairement sur la ligne du haut qu’une cellule est présente tandis que sur la ligne du bas, deux cellules sont observées. Le cercle jaune montre la position d’une bille qui sert de référence d’emplacement pour confirmer que la même colonie est imagée dans le temps.
Les preuves typiques de monoclonalité que les régulateurs recherchent sont basées sur des images, c’est-à-dire que l’image d’une cellule unique doit être enregistrée.
L’équipement de développement de lignées cellulaires monoclonales le plus efficace est une imprimante à cellule unique, qui effectue le dépôt de cellules uniques. Les autres méthodes incluent le tri cellulaire activé par fluorescence (FACS) et les flux de travail qui automatisent chaque étape, de l’incubation au pipetage.
Importance de la vérification précoce de la monoclonalité
L’assurance de monoclonalité à un stade précoce a plusieurs implications pour les applications des sciences de la vie. Le Dr Graham souligne l’importance de la monoclonalité pour le cycle de développement des médicaments : « Il y a des lignées cellulaires et des molécules qui vont vers la commercialisation et qui ont été développées il y a dix ans ou plus. Les procédés de clonage d'il y a dix ans peuvent ne pas disposer de la documentation nécessaire pour garantir une origine clonale. Lorsque l’on amène une telle lignée cellulaire à un régulateur, on peut vous demander de montrer qu’elle provient à l’origine d’une lignée cellulaire clonale. Si vous n’avez pas cette preuve, la prouver plus tard dans le projet est un travail important. »
Le Dr Skoko ajoute : « Il s’agit de minimiser les risques et d’avoir un processus de production et une qualité de produit uniformes. C’est pourquoi il est essentiel d’assurer la monoclonalité dès le début. Commencer avec une banque de cellules avec une assurance élevée de monoclonalité permet de travailler moins tard. De plus, vous éviterez les perturbations graves de la fabrication et réduirez l’incertitude lorsque vous apporterez des modifications au procédé de fabrication. »
Technologies monoclonales émergentes pour vérifier les lignées cellulaires uniques
Les techniques émergentes pour l’imagerie de lignées cellulaires monoclonales et la culture se développent. Voici quelques exemples :
- La suspension cellulaire semi-solide, dans laquelle une cellule unique se développe en suspension semi-solide, peut être évaluée par imagerie au fur et à mesure de sa croissance.
- Un anneau de clonage entourant une cellule unique pour l’isoler et la protéger de la contamination
- FACS : Tri des cellules en fonction des caractéristiques fluorescentes
- Imprimantes monocellulaires microfluidiques à base de gouttes avec la possibilité d’évaluer par imagerie des puits nouvellement ensemencés contenant des cellules uniques
Ces méthodes combinées améliorent la fiabilité des preuves de monoclonalité.
Bien sûr, il existe un grand potentiel pour améliorer les techniques actuelles et inventer des techniques supérieures. Tout d’abord, les preuves visuelles, c’est-à-dire l’imagerie de cellules uniques, doivent être utilisées plus souvent, car elles permettent de surmonter les défis liés au coût et au temps liés à la limitation de la dilution et au tri par cytométrie en flux.
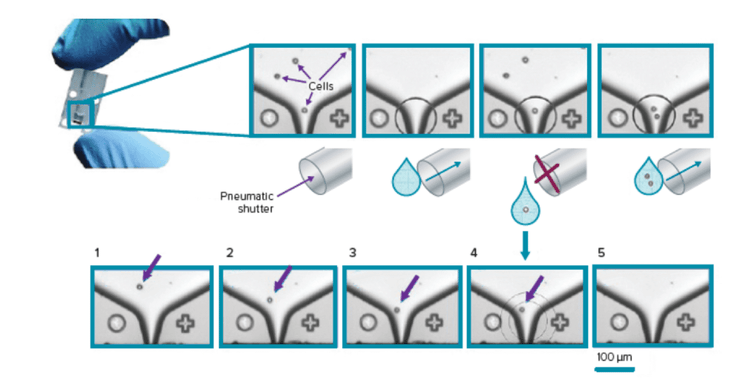
La série CloneSelect Single-Cell Printer est un système entièrement automatisé qui utilise une technologie microfluidique exclusive et l’analyse d’images en temps réel pour trier et déposer des cellules uniques dans des microplaques standard, tout en garantissant simultanément la monoclonalité grâce à la documentation d’images.
D’autres améliorations sont possibles sur la ligne de production. Par exemple, l’amélioration des méthodes analytiques dans la production de protéines thérapeutiques peut nous aider à surveiller l’ensemble du processus de fabrication. Cela permet de contrôler la variation génétique et garantit l’uniformité de la protéine fabriquée.
La vitesse est une autre préoccupation dans le développement de lignées cellulaires monoclonales. Comme le souligne le Dr Graham, « Attendre une lignée cellulaire clonale pour faire entrer votre protéine dans une clinique est une barrière en termes de temps. Aujourd’hui, les gens se dirigent vers les premiers lots de protéines provenant de pools de clones précoces pour le premier matériel clinique des bonnes pratiques de fabrication (BPF). Ensuite, on génère la lignée cellulaire clonale pour les essais cliniques à un stade ultérieur et la production de BPF. L’élimination de la nécessité d’une preuve d’origine clonale dans les essais cliniques précoces est une approche intéressante pour accélérer le développement de biothérapeutiques. Toutefois, cette approche peut nécessiter un travail supplémentaire pour obtenir l’approbation réglementaire. »
Le rôle de la régulation et son impact sur le processus de développement de lignées cellulaires
Comme vous pouvez le constater, les réglementations ont un impact indéniable sur le développement de lignées cellulaires monoclonales. L’une des implications des réglementations strictes est que le fabricant doit fournir un rapport complet sur la lignée cellulaire monoclonale avant de demander l’approbation. Une preuve insuffisante ou des documents manquants peuvent entraîner des retards réglementaires ou des engagements supplémentaires après approbation. Étant donné que l’approbation réglementaire nécessite un excellent soutien scientifique, il est préférable de fournir autant de preuves que possible dès les premiers stades, en particulier pour l’origine clonale.
Qu’est-ce que l’avenir réserve aux flux de travail de lignées cellulaires monoclonales ?
Il existe des défis non résolus dans les flux de travail de lignées cellulaires monoclonales, notamment des problèmes financiers, l’obtention de résultats haut débit et l’assurance de l’origine monoclonale.
Par rapport aux méthodes existantes, les développeurs de lignées cellulaires monoclonales d’aujourd’hui disposent de bien meilleurs outils pour garantir la conformité réglementaire et la qualité des lignées cellulaires.
Une perspective intéressante est une meilleure gestion des données, qui est nécessaire pour organiser de grands ensembles de données générés à partir des études de développement de lignées cellulaires. La combinaison de la gestion des données et de l’apprentissage machine peut donner lieu à une plateforme qui prédit la qualité d’une biothérapeutique basée uniquement sur l’origine clonale.
Le rôle de l’automatisation deviendra également plus essentiel en termes de vitesse et de cohérence. Plus précisément, l’automatisation peut accélérer le développement de clones et le criblage de colonies. Le Dr Skoko clarifie les effets de l’automatisation : « Nous parlons du criblage des 10 000 clones dans quelques semaines. Un flux de travail traditionnel prendrait entre 30 semaines et deux ans. La technologie automatisée peut nous aider à avoir des clones précis, à éliminer les erreurs associées à la dilution limite traditionnelle et à surmonter le travail avec une population hétérogène de différents sécréteurs. Vous pouvez évaluer la stabilité de vos clones dès le début. »
Flux de travail automatisé de développement de lignées cellulaires avec assurance de monoclonalité
Grâce à l’intégration des technologies d’automatisation, vous pouvez cribler des centaines de milliers de clones pour trouver ce clone doré qui peut générer le plus haut rendement pour la protéine qui vous intéresse. Plus important encore, il vous aide à documenter entièrement chaque étape du processus de développement dès le jour 0. En fin de compte, vous économisez de l’argent et du temps en évitant les conflits futurs causés par un manque d’assurance de monoclonalité ou une qualité de produit incohérente.
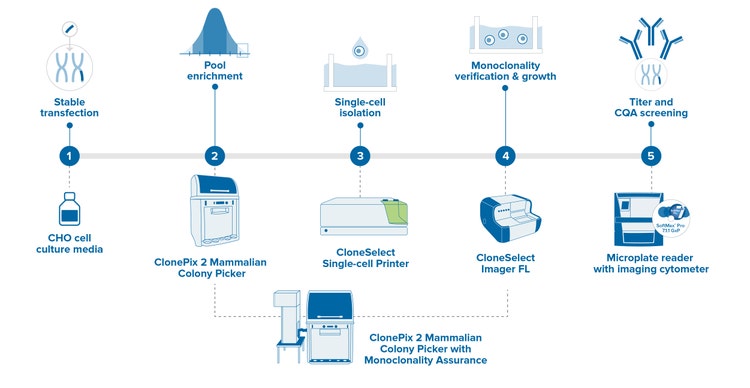
Accélérez vos délais de développement de lignées cellulaires en intégrant plusieurs étapes en une seule étape. Le système amélioré ClonePix de repiquage de colonies de 2 mammifères avec assurance de monoclonalité peut automatiquement cribler et sélectionner des clones à la fois à haute production et monoclonaux, le tout dans un seul système. Criblez davantage de clones en moins de temps avec la vérification de la monoclonalité au jour 0, puis criblez et sélectionnez les produits les plus performants en moins de deux semaines. La fonction d’acquisition rapide de Z Stack permet de détecter les cellules uniques dans tout le volume du milieu, et pas seulement dans un seul plan focal, au jour

Molecular Devices dispose d’un portefeuille robuste pour automatiser votre flux de travail et vos technologies de développement de lignées cellulaires afin de garantir la monoclonalité, notamment la sélection de clones, l’isolation et l’imagerie de cellules uniques, et les lecteurs de microplaques. Nos solutions GxP éprouvées garantissent l’intégrité et la conformité des données pour les laboratoires BPF/BPL.
En savoir plus sur le développement de lignées cellulaires et les applications de monoclonalité ou parler à un spécialiste de l’automatisation si vous souhaitez découvrir une solution automatisée pour votre laboratoire.