Rôle des anticorps monoclonaux dirigés contre la COVID-19
Découvrez pourquoi les mAb sont essentiels dans la lutte contre le SARS-CoV-2 et comment la pandémie a marqué leur découverte et leur processus de développement.
Au cours des trois dernières années, le développement de traitements contre la COVID-19 a pris une ampleur considérable. La vaccination a été à l’avant-garde de la lutte. Grâce à l’administration d’ARNm, les vaccins incitent vos cellules à produire une version inoffensive de la protéine spike, stimulant ainsi votre système immunitaire à produire des anticorps pour combattre la menace potentielle. La question est de savoir ce qui se passe lorsque vous avez déjà contracté la COVID-19 ou lorsque votre système immunitaire est compromis de sorte que vous courez un risque élevé d’hospitalisation, même après la vaccination. C’est là que les anticorps monoclonaux entrent en jeu en ciblant et neutralisant le virus après qu’il ait envahi l’organisme.
podcast présenté
Dans le dernier podcast de Drug Target Review (Episode 6 - mAbs and SARS-CoV-2 with Dr. Carter Mitchell & Dr. Sharath Madasu, Kemp Proteins ), Carter Mitchell, Directeur scientifique et Sharath Madasu, Responsable de la caractérisation des protéines de Kemp , ont discuté du rôle des anticorps monoclonaux (mAb) contre la COVID-19 et de la façon dont la pandémie a façonné leur découverte et leur développement.
Examen des cibles médicamenteuses · Épisode 6 -AcM et SARS-CoV-2 avec le Dr Carter Mitchell et le Dr Sharath Madasu, protéines Kemp
Table des matières
Pourquoi les mAb sont-ils efficaces contre le SARS-CoV-2 ?
Les anticorps monoclonaux (mAb) agissent sur les virus par neutralisation virale. Ils sont efficaces car ils interrompent le processus par lequel le virus reconnaît l’hôte ou le virus est internalisé.
Mécanisme de travail des anticorps monoclonaux
Dans le SARS-CoV-2, l’objectif est de perturber la liaison de la protéine spike avec les récepteurs ACE2, interdisant l’entrée du virus dans les cellules hôtes. La protéine Spike sert de médiateur à la liaison par le biais de son domaine de liaison de reconnaissance (RBD). Actuellement, la plupart des anticorps monoclonaux neutralisants sont dirigés contre le RBD.
Quelle est l’efficacité des anticorps monoclonaux contre les variantes de la COVID-19 ?
En matière d’efficacité, il est difficile de donner une seule réponse en raison du nombre croissant de variantes. L’efficacité varie selon les variantes. Par exemple, bien que la plupart des anticorps autorisés pour une utilisation d’urgence fonctionnent sur les variantes Alpha et Delta, ils présentent une efficacité plus faible dans la variante Omicron.
Le challenge avec Omicron est qu’il y a au moins 36 mutations sur la protéine spike, dont certaines sont situées sur le RBD. Ces mutations entraînent une glycosylation différentielle, ce qui permet au virus d’échapper aux réponses immunologiques précédemment formées ou à la neutralisation des anticorps monoclonaux.
Heureusement, les anticorps plus récents, tels que le sotrovimab, ont réussi à conserver leur activité neutralisante dans les variantes récentes, il y a donc encore un éclat d’espoir. Néanmoins, l’efficacité peut varier considérablement. Certains anticorps sont très efficaces contre les variantes alpha et bêta, mais pas contre les variantes gamma ou delta. En revanche, les anticorps efficaces contre Delta et Alpha sont beaucoup moins efficaces contre les variantes Beta, Gamma et Omicron.
L’impact d’une mutation de variant particulière sur EC50 dépend de la présence ou non des mutations au niveau de l’épitope de liaison.
Avantages des mAb par rapport aux autres traitements contre la Covid-19
Le niveau de certitude de la dose requise est l’un des principaux avantages des anticorps monoclonaux dans le traitement de la COVID-19.
Selon le Dr Madasu, le taux de succès de la thérapie par plasma de convalescence dépend fortement du donneur. Madasu explique en outre : « Avec le traitement par plasma de convalescence, A) vous vous attendez à ce que le donneur produise toujours des anticorps neutralisants, et B) le donneur produit des quantités suffisantes pour être efficace du tout. Avec les anticorps monoclonaux, nous savons exactement à quel point nous administrons un anticorps neutralisant au patient, ce qui est un énorme avantage. »
La thérapie par convalescence du plasma entraîne également un risque important d’incompatibilités plasmatiques entre les patients. L’utilisation d’anticorps monoclonaux comme méthode de traitement efficace contre la COVID-19 réduit significativement ces risques.
Le Dr Mitchell souligne une autre caractéristique remarquable du traitement mAb, la capacité à produire un sous-ensemble de mélange pseudo-polyclonal qui peut neutraliser tout type de variant qui pourrait émerger à l’avenir. On peut se demander : Comment pouvons-nous être si sûrs que ces anticorps seront efficaces contre les futures variantes ? Étant donné que chaque sous-ensemble a un épitope de liaison spécifique, les mutations peuvent être rapidement reconnues par un sous-ensemble mAb ou une combinaison de sous-ensembles mAb.
Le Dr Mitchell donne un exemple vraisemblable des avantages potentiels des mélanges polyclonaux. « Dans cinq ans, si un nouveau type de variant sort, nous pourrons peut-être utiliser un anticorps monoclonal élevé contre le type sauvage PLUS qui est apparu en 2023 traitement combiné pour avoir plus d’efficacité contre ce variant particulier. »
L’effet d’une pandémie soudaine
Le développement d’anticorps monoclonaux a indéniablement progressé. La question reste la suivante : les avancées dans la production d’anticorps monoclonaux auraient-elles encore eu lieu si cela n’avait pas eu lieu pendant la pandémie de COVID-19 ?
Bien que le processus de développement d’anticorps monoclonaux ait déjà été établi, la pandémie a créé un sentiment d’urgence. Le Dr Madasu estime également que les personnes ont une meilleure compréhension des traitements par anticorps que celle des vaccins. Au cours de la phase précoce de la pandémie, il n’était pas clair dans quelle mesure un vaccin serait efficace, donc certaines parties des personnes peuvent avoir hésité à prendre le vaccin. D’autre part, les personnes avaient un plus grand sens de la compréhension des anticorps, donc les traitements à base d’anticorps étaient plus largement acceptés.
La pandémie a non seulement accéléré l’amélioration des stratégies existantes, mais elle a également conduit au développement de nouvelles techniques. Les technologies, telles que la résonance plasmonique de surface (SPR) à haut débit, l’interférométrie biocouche (BLI) à haut débit ont suscité un intérêt pendant la pandémie. En outre, la diffusion dynamique de la lumière (DLS) à haut débit et la FLD se sont également beaucoup améliorées. L’une des technologies les plus récentes était la conception d’anticorps monoclonaux De Novo basée sur l’intelligence artificielle, qui a augmenté la vitesse et la complexité des plateformes de détection d’anticorps .
Flux de travail des anticorps monoclonaux contre la COVID-19
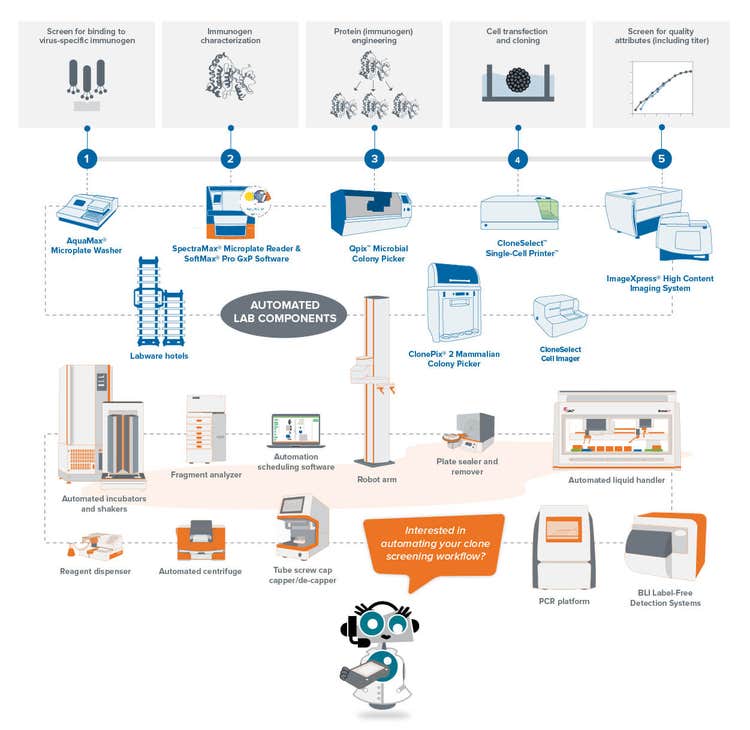
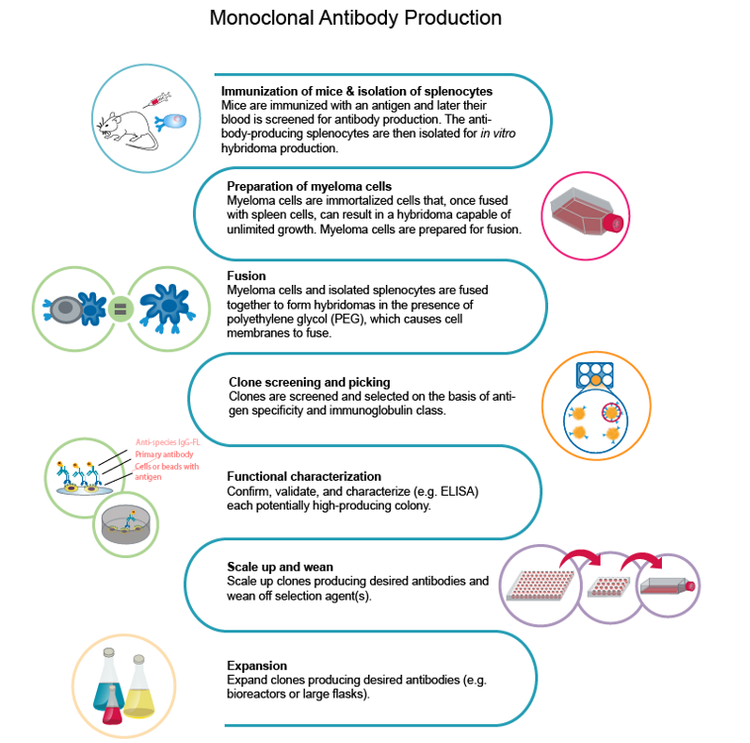
La première étape pour construire le flux de travail est le choix de l’antigène à utiliser pour développer des anticorps monoclonaux . Au stade initial, l’immunisation se produit en administrant l’antigène à un animal qui développe une réponse immunitaire. Ensuite, les cellules bêta générées pendant la réponse immunitaire animale sont isolées, puis fusionnées avec une cellule de myélome pour générer l’hybridome.
Selon le Dr Mitchell, la clé d’une étape initiale réussie est l’optimisation de l’antigène. « Dans le cas de la COVID-19, les anticorps sont principalement élevés contre la protéine spike, qui est un trimestre. La protéine spike a une propension à former des agrégats de poids moléculaire élevé, ce qui peut ne pas être important pour la stratégie de vaccination ».
De plus, les profils de glycosylation de la protéine spike varient fortement selon les types de cellules, et encore moins selon les espèces.
C’est pourquoi il faut être très prudent dans la sélection des antigènes. Même une légère déviation d’un seul antigène glycane (par exemple, dans différentes variantes) peut avoir un impact significatif sur le taux de succès de l’anticorps.
https://main--moleculardevices--hlxsites.hlx.page/applications/monoclonal-antibody-production
Difficultés et goulots d’étranglement
Immunisation
L’un des principaux défis est la compréhension du génome viral. Les équipes de recherche devaient généralement synthétiser et purifier les antigènes et optimiser leur expression. Cependant, pour évaluer le succès de l’expression et de la purification, ils ont dû compter sur la nature collaborative des scientifiques pour publier les informations de leurs propres laboratoires. Dans l’ensemble, l’immunisation d’un animal et la génération d’hybridomes seuls pourraient prendre jusqu’à huit semaines.
Isolation de cellule unique
Après avoir identifié l’antigène de la meilleure qualité pour la stratégie de vaccination, le défi suivant est d’obtenir un nombre suffisant de cellules B pour l’isolation des cellules uniques de l’hybridome.
La méthode traditionnelle pour développer ces hybridomes est un milieu semi-solide qui permet à la cellule unique de former une colonie. Il s’agissait d’un processus lent, mais il a depuis pris de l’ampleur avec des instruments robotisés qui permettent d’imprimer des cellules uniques dans chaque puits d’une microplaque, améliorant ainsi le débit et l’efficacité.
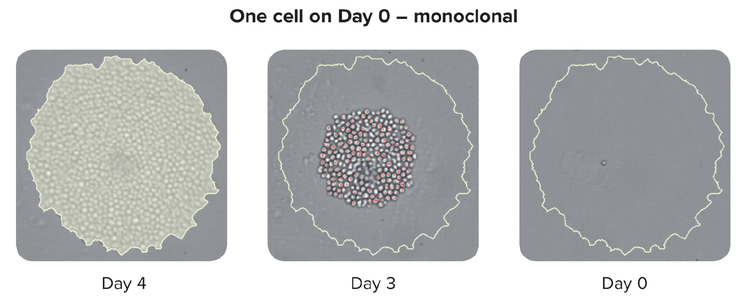
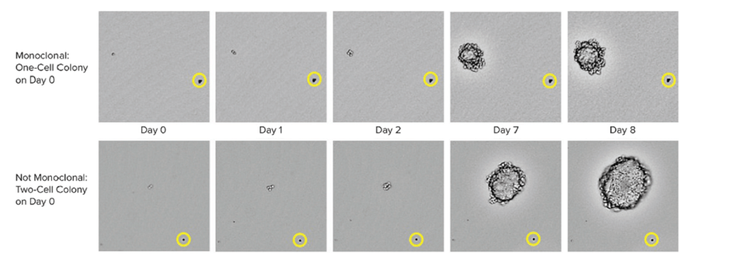
Il est important de noter que les outils avancés d’isolation des cellules uniques permettent également une efficacité accrue de l’excroissance clonale et la vérification de monoclonalité que la colonie a été générée à partir d’une cellule unique.
monoclonalité à grande échelle
Pour la monoclonalité à grande échelle, il est nécessaire de générer la forme recombinante d’un hybridome isolé d’une cellule unique, car l’isolation d’une cellule unique est insuffisante pour la génération d’AcM cliniquement pertinents. L’approbation pour les essais cliniques nécessiterait la génération recombinante de l’AcM et sa formulation en anticorps humain qui permet la réponse immunologique appropriée.
Pour former des lignées cellulaires stables pour générer des mAb à des concentrations suffisantes, vous devez séquencer et manipuler le gène dans une construction humaine. Les lignées cellulaires CHO sont utilisées pour la génération recombinante, dans le but de produire des mAb 8de à20 g/l.
https://main--moleculardevices--hlxsites.hlx.page/applications/monoclonality
Contraintes de temps et financières
Le temps et le coût sont des facteurs clés à prendre en compte dans les flux de travail mAb
Bien que la génération de clones stables puisse être obtenue en 12 jours après l’alimentation initiale, l’assurance monoclonale complète peut prendre jusqu’à six mois avec les méthodes de clonage traditionnelles. Plus important encore, générer une structure mAb entièrement réalisée peut être coûteux. La solution serait de former des anticorps à fragment variable à chaîne unique ou des nanocorps VHH. Il s’agit des plus petits fragments d’anticorps possible présentant une affinité de liaison spécifique pour un antigène. Le Dr Mitchell résume pourquoi cette approche est si puissante :
« En convertissant les mAb en nanocorps plus petits, nous pouvons les produire dans E. coli de manière beaucoup plus rentable. Cela réduit les coûts, ce qui en fait un produit thérapeutique largement applicable par opposition à ceux qui sont uniquement accessibles dans les pays développés. »
Selon le Dr Madasu, leurs structures stables rendent la distribution dans les pays moins développés plus facile. « Nous devons penser à d’autres pays moins développés sans accès aux installations de stockage. Certains de ces nanocorps sont assez stables et peuvent être stockés dans des conditions moins strictes. »
Il est évident que la conversion anticorps-nanocorps est une étape cruciale pour distribuer des traitements à base d’AcM dans le monde entier à un coût plus faible. En particulier dans les pays moins développés avec des installations de stockage insuffisantes, les nanocorps resteraient stables à des températures extrêmes.
Garantir la monoclonalité et accélérer la production d’AcM anti-COVID-19 grâce à l’automatisation
Assurance de monoclonalité
Les méthodes pour garantir la monoclonalité à grande échelle incluent des technologies automatisées telles que l’impression de cellules uniques ou la sélection de colonies. Lors du repiquage d’une colonie isolée à partir du milieu HAT, l’instrument prend des images dans un laps de temps à partir du jour zéro après le repiquage de la colonie. La preuve du témoin visuel constitue une preuve de monoclonalité. Pour garantir des clones haute performance, les laboratoires peuvent utiliser des tests cellulaires ou immunitaires combinés à des méthodes basées sur des images. Cette stratégie combinée garantit que vous avez une monoclonalité et que vos clones sécrètent une seule variété de l’anticorps. En dernière étape du processus, il est également utile de réaliser des tests de liaison d’épitope pour déterminer si la liaison d’épitope est uniforme.
https://main--moleculardevices--hlxsites.hlx.page/applications/monoclonality
Le rôle de la robotique dans le délai d’exécution
La meilleure façon de réduire le délai de développement est de mettre en œuvre une robotique haut débit pour interroger les clones. Dans les flux de travail automatisés mAb pour la COVID-19, la purification automatisée a été d’une immense aide pour comprendre le comportement des clones et la possibilité que l’anticorps monoclonal produise des agrégats de poids moléculaire élevé.
L’utilisation de la robotique à haut débit est toujours un avantage pour la mise sur le marché de nouveaux agents thérapeutiques. Cette méthode offre une meilleure vue d’ensemble de l’espace protéique ou de l’espace épitopique. Le fait d’avoir un grand nombre de clones maximise vos chances d’obtenir des mAb qui couvrent tous les attributs souhaités au lieu d’avoir un mAb unique avec une couverture partielle de l’antigène.
Avec les flux de travail haut débit, on peut réduire la mise au point dans un sous-ensemble de monoclones avec le rendement le plus élevé. Vous pouvez ensuite passer aux sous-ensembles les mieux classés pour réaliser d’autres évaluations dans les études sur les animaux et les tests de toxicologie. Vous gagneriez également du temps en éliminant les sous-ensembles non adaptés aux purifications à grande échelle, ce qui évite les pertes financières pendant le parcours de recherche sur la COVID-19 en laboratoire.
Automatisation des procédés de laboratoire mAb à l’avenir
De nombreux laboratoires de recherche sur la COVID-19 ont déjà mis en œuvre des processus automatisés car ils sont en mesure de générer des données pour des milliers de clones par semaine. La compréhension des mécanismes thérapeutiques mAb est beaucoup plus probable avec la synthèse, l’expression, la purification et la caractérisation biophysique automatisées.
Plus important encore, l’automatisation ouvre la voie à des méthodes d’analyse et des critères de sélection sans biais. L’analyse objective est nécessaire pour diversifier la bibliothèque d’anticorps pour un large éventail de variantes et de mutations afin d’éviter la mise à l’échelle des anticorps qui ne traitent qu’un ensemble étroit de variantes.
L’avenir de la recherche sur le SARS-CoV-2 et le rôle des anticorps monoclonaux
Les agents thérapeutiques à base d’AcM sont commercialisés aux États-Unis 1986 depuis la première approbation par la FDA de l’AcM du développement du muromonab-CD3 (Orthoclone OKT3) pour réduire le rejet aigu chez les patients ayant reçu une greffe d’organe. (1) Les recherches actuelles sur la COVID-19 augmentent également la signification des anticorps monoclonaux dans les diagnostics. En fait, les anticorps monoclonaux ont joué un rôle essentiel dans la détection des variants du SARS-CoV-2.
Outre les diagnostics, les mAb actuels aident les chercheurs à déterminer les modifications nécessaires et même à éclairer le développement de vaccins candidats. Pour déterminer si un mAb de référence peut neutraliser un variant du virus, les chercheurs peuvent décider s’il faut développer de nouveaux agents thérapeutiques plus efficaces.
Alors que les vaccins à base d’ARNm ont été au centre de la lutte contre la COVID-19, les anticorps monoclonaux ont été en coulisses de diverses applications, des vaccins à base de protéines aux agents thérapeutiques à base d’anticorps.
Le Dr Madasu et le Dr Mitchell estiment qu’à l’avenir, les anticorps monoclonaux pourraient être appliqués en particulier à la population non vaccinée, y compris les nourrissons, les patients présentant des comorbidités (qui ne répondent pas bien aux vaccins) et les personnes hésitant à se faire vacciner. Comme indiqué précédemment, la clé est de produire des agents thérapeutiques à base d’AcM rentables et de les rendre aussi largement disponibles que possible, en augmentant l’efficacité du processus de découverte et de production.
Détection d’anticorps monoclonaux contre la COVID-19 avec les solutions d’automatisation de laboratoire de Molecular Devices
Le criblage de clones est l’un des goulots d’étranglement de la détection d’anticorps monoclonaux, car vous devez tester et analyser des milliers de cellules par rapport à l’antigène cible. Les flux de travail automatisés de criblage de clones peuvent aider à surmonter ce fardeau en réduisant le temps de manipulation et en unifiant et normalisant les données extraites de plusieurs processus.
Molecular Devices a conçu des solutions de flux de travail intégrées pour les étapes essentielles. Les flux de travail automatisés de développement de lignées cellulaires visent à produire des lignées cellulaires monoclonales produisant des niveaux constants et suffisants de la protéine thérapeutique cible. Le flux de travail automatisé de clonage moléculaire vise à minimiser les erreurs et la contamination pendant l’isolation des séquences d’ADN , qui se propagent sous forme de vecteurs dans les espèces de votre choix.
Ces flux de travail maximisent le rendement des protéines cibles tout en offrant la possibilité d’intégrer d’autres instruments pour une cellule de travail entièrement automatisée avec la robotique. Dans l’ensemble, ces flux de travail sont rentables, font gagner du temps et sont faciles à modifier avec l’évolution des objectifs de recherche.
Sur notre page Automatisation de laboratoire pour le criblage de clones à haut débit, vous pouvez en apprendre davantage sur les flux de travail de développement de lignées cellulaires plus en profondeur. N’oubliez pas de consulter notre page d’application sur les anticorps monoclonaux pour voir les méthodes de production d’AcM et les complexités de chaque étape impliquée.
- Wang, S. S., Yan, Y. S., & Ho, K. ( 2021). Anticorps thérapeutiques approuvés par la FDA américaine avec formulation à haute concentration : résumés et perspectives. Anticorps thérapeutiques , 4(4), 262-272. https://doi.org/10.1093/abt/tbab027