L’AVENIR DE
LA BIOLOGIE COMPLEXE
Le système automatisé de culture cellulaire CellXpress.ai
Visualiser la différence. Choisir les meilleures. Système de sélection de colonies microbiennes QPix FLEX
Obtenez des informations plus approfondies : système de criblage haut contenu ImageXpress HCS.ai avec informations basées sur l’IA
Lecteurs de microplaques SpectraMax® et SoftMax® Pro Software de pointe
Entreprise spécialisée dans les sciences de la vie
We journey alongside researchers, combining next-gen technology and deep expertise to spark bold breakthroughs that push research boundaries and transform lives worldwide.
Faire progresser les découvertes scientifiques
Unlocking the full potential of complex biology, human-relevant models, AI-driven discovery, and next-generation therapeutics is key to navigating what's next in life sciences. We partner with you to pave the way.


We believe in the power of collaboration.
Today’s scientific breakthroughs demand more than just advanced tools. They require partnerships built on understanding, commitment, and trust. Collaboration in life sciences plays a critical role in fueling advancements and unlocking new frontiers in discovery.
At Molecular Devices, we stand shoulder to shoulder with customers as indispensable partners. Whether enabling the adoption of complex biology, supporting human-relevant model research, integrating AI and machine learning, or validating the next generation of therapeutic modalities, we empower transformational breakthroughs.

Unlocking the full potential of complex biology to revolutionize research.
Our industry expertise and advanced technologies are unlocking the potential for complex biology to revolutionize scientific research. We partner with customers to create tailored, automated workflows that streamline complexity, increase throughput, and accelerate breakthroughs with confidence.

Making human-relevant model-based research more accessible.
Complex cell models mirroring human biology are key to reducing the persistently high attrition rate of drug candidates in clinical trials. From automated cell culture systems and screening solutions to an abundance of ready-for-use organoids from our lines or yours, we enable researchers to reliably assess the safety and efficacy of therapies based on human-relevant models from the outset.
Unleashing the power of AI and machine learning to advance discovery.

Harnessing AI and machine learning puts scientists in the strongest ever position to industrialize and interrogate complex biology. From cell culturing to smart imaging to advanced data analysis, our automated, AI-enabled, end-to-end solutions free researchers from making regular, mundane checks so they can invest their time on transformative science.
Assuring validation to accelerate time to market for new therapeutics

If new therapeutic modalities are to realize their promise, traceable audit-ready software and hardware must evolve alongside them. Our solutions offer the data integrity needed to accelerate next-generation therapies.
Your indispensable partner in complex biology
Our advanced instruments and automated workflows—built alongside you—unlock new possibilities, streamlining complexity so you can focus on discovery.

Lecteurs de microplaques configurables, intuitifs et faciles à utiliser
Nous travaillons en partenariat avec des chercheurs depuis plus de 40 ans pour repousser les limites de leurs recherches. Nos lecteurs de microplaque SpectraMax et nos logiciels SoftMax Pro Software sont les plus cités du secteur et ont permis aux chercheurs en sciences de la vie de faire des avancées dans le domaine des protéines et de la biologie cellulaire, brisant les obstacles pour laisser place à de nouvelles découvertes historiques.

Optimisez votre mise en conformité BPx dans les laboratoires BPL/BPF
Leader en matière de solutions complètes de mise en conformité GxP, nous combinons nos lecteurs de microplaques SpectraMax®, le logiciel SoftMax® Pro GxP, les plaques de validation SpectraTest® et les services experts IQ/OQ/PM pour aider les laboratoires fonctionnant conformément aux réglementations BPF et BPL à suivre en toute confiance les directives réglementaires de la FDA ou de leur pays.
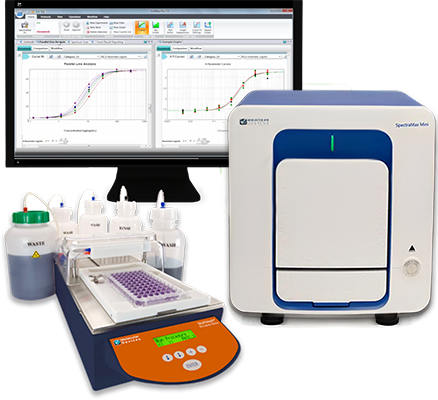
Faites des économies grâce à une offre groupée de lecteur de microplaques et de laveur
Améliorez l’efficacité de votre laboratoire, obtenez plus de données et réduisez le temps de découverte grâce à une solution automatisée de lavage et de lecture de microplaques :
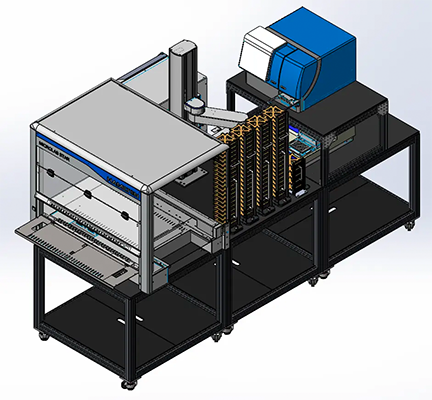
Automatisation de laboratoire pour les tests sur plaque haut débit
Découvrez nos solutions de flux de travail totalement automatisées et intégrées pour les tests cellulaires et biochimiques. Nos cellules de travail ELISA évolutives réduisent le temps d’attente, augmentent le débit, l’efficacité et le rendement de la procédure de test, ainsi que sa reproductibilité.

Lecteurs de microplaques configurables, intuitifs et faciles à utiliser
Nous travaillons en partenariat avec des chercheurs depuis plus de 40 ans pour repousser les limites de leurs recherches. Nos lecteurs de microplaque SpectraMax et nos logiciels SoftMax Pro Software sont les plus cités du secteur et ont permis aux chercheurs en sciences de la vie de faire des avancées dans le domaine des protéines et de la biologie cellulaire, brisant les obstacles pour laisser place à de nouvelles découvertes historiques.

Optimisez votre mise en conformité BPx dans les laboratoires BPL/BPF
Leader en matière de solutions complètes de mise en conformité GxP, nous combinons nos lecteurs de microplaques SpectraMax®, le logiciel SoftMax® Pro GxP, les plaques de validation SpectraTest® et les services experts IQ/OQ/PM pour aider les laboratoires fonctionnant conformément aux réglementations BPF et BPL à suivre en toute confiance les directives réglementaires de la FDA ou de leur pays.

Automatisation de laboratoire pour les tests sur plaque haut débit
Découvrez nos solutions de flux de travail totalement automatisées et intégrées pour les tests cellulaires et biochimiques. Nos cellules de travail ELISA évolutives réduisent le temps d’attente, augmentent le débit, l’efficacité et le rendement de la procédure de test, ainsi que sa reproductibilité.


Système de criblage haut contenu ImageXpress® HCS.ai pour une meilleure analyse des données et des informations basées sur l’IA
Se distingue par sa conception modulaire avancée et sa capacité à capturer rapidement des images ultra claires de modèles cellulaires complexes, à acquérir des données détaillées avec un logiciel intuitif, et à offrir des informations approfondies en tirant parti de l’analyse basée sur l’IA.


Introducing the revolutionary CellXpress.ai® Automated Cell Culture System
Centre d’innovation de culture cellulaire basé sur l’IA, le système CellXpress.ai automatise les processus, améliore les flux de travail et renforce la fiabilité et la reproductibilité des tests grâce à la surveillance, l’alimentation, l’imagerie et la programmation assistées par l’apprentissage automatique (machine learning).
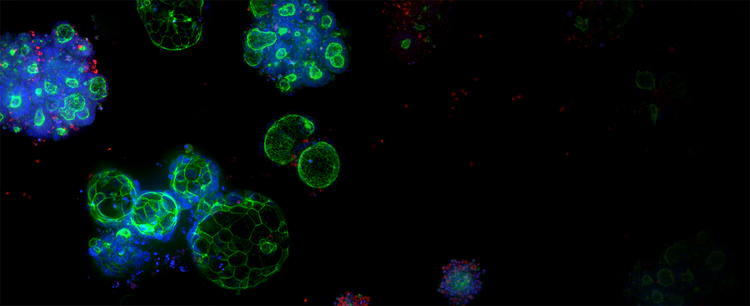
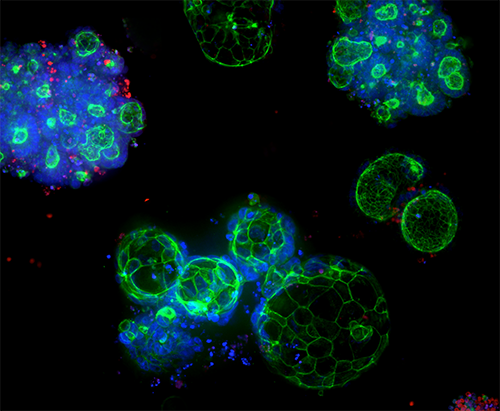
Services d’expansion d’organoïdes et organoïdes 3D Ready
Les organoïdes de qualité contrôlée sont fabriqués à une échelle adaptée au criblage haut débit, en exploitant une technologie exclusive de bioréacteur et de bioprocédé pour produire des organoïdes dérivés de patient (ODP) fiables et prédictifs.

Le système de sélection de colonies microbiennes QPix® FLEX™ pour la précision, la flexibilité et les environnements à espace limité
Ensemencement, étalement, sélection et manipulation des liquides, le tout dans un seul appareil compact ? Avec le système de sélection de colonies microbiennes QPix FLEX, cela semble facile. Grâce à l’imagerie couleur avancée, vous pouvez marquer plus rapidement les bonnes colonies. Et oui, il s’adapte sur votre paillasse ou dans une chambre hypoxique, pourquoi pas après tout ? Le système QPix FLEX réduit l’encombrement avec un système intelligent et optimisé conçu pour faire avancer vos recherches.

Systèmes de criblage de clones pour la sélection de colonies et l’isolation de cellules uniques
Le système de sélection de colonies microbiennes 400 QPix® et de colonies de cellules de mammifères 2 ClonePix®, et l’imageur CloneSelect® FL augmentent le débit et l'homogénéité dans tous les flux de travail de développement de lignées cellulaires, de détection d’anticorps monoclonaux et de biologie de synthèse.

Solutions automatisées pour le criblage haut débit de clones
Solution d’automatisation de laboratoire entièrement intégrée pour le clonage moléculaire, la détection d’anticorps et la monoclonalité. Nos protocoles automatisés de criblage de clones intègrent des appareils de laboratoire pour augmenter votre débit et votre efficacité tout en réduisant l’intervention humaine.

Distribution de cellules uniques et criblage pour vérifier la monoclonalité.
Distributeur de cellules uniques primé DispenCell™ et CloneSelect® Imager FL – notre solution groupée offre une précision et une efficacité inégalées pour le développement de lignées cellulaires et la vérification de la monoclonalité, dès le premier jour.

Systèmes de criblage de clones pour la sélection de colonies et l’isolation de cellules uniques
Le système de sélection de colonies microbiennes 400 QPix® et de colonies de cellules de mammifères 2 ClonePix®, et l’imageur CloneSelect® FL augmentent le débit et l'homogénéité dans tous les flux de travail de développement de lignées cellulaires, de détection d’anticorps monoclonaux et de biologie de synthèse.

Solutions automatisées pour le criblage haut débit de clones
Solution d’automatisation de laboratoire entièrement intégrée pour le clonage moléculaire, la détection d’anticorps et la monoclonalité. Nos protocoles automatisés de criblage de clones intègrent des appareils de laboratoire pour augmenter votre débit et votre efficacité tout en réduisant l’intervention humaine.
Nous sommes des chercheurs aidant d’autres chercheurs
Our experts help researchers move beyond traditional testing with complex, human-relevant models—unlocking faster, smarter breakthroughs that truly translate.

Biologie 3D : le changement de paradigme dans la découverte des médicaments de nouvelle génération
Au cœur d’un paradigme de découverte de médicaments en évolution, les chercheurs du monde entier abandonnent les cultures cellulaires 2D et les modèles animaux pour cribler leurs composés et les remplacent par des systèmes 3D plus complexes et pertinents pour l’être humain, tels que les organoïdes. Découvrez notre infographie interactive qui vous explique de manière approfondie pourquoi le secteur adopte cette nouvelle génération de découverte de médicaments et qui décrit les innovations qui vous aident dans votre parcours dans la biologie 3D.
Recherche et développement de médicaments
Le paysage de la découverte de médicaments est en train de changer. De plus en plus de chercheurs centrent le développement de lignées cellulaires, de modèles de maladie et de méthodes de criblage haut débit sur des modèles cellulaires 3D pertinents d’un point de vue physiologique.
La raison est claire : l’utilisation, dans la recherche, de systèmes de modèles cellulaires qui reproduisent fidèlement les états pathologiques des patients ou les organes humains permet de commercialiser plus rapidement des agents thérapeutiques susceptibles de sauver des vies.
Modèles cellulaires 3D
Grâce à nos solutions automatisées de culture cellulaire 3D et de criblage par bio-imagerie, nous contribuons à redéfinir l’avenir de la découverte de médicaments. Grâce à notre technologie et à nos protocoles de développement d’organoïdes, vous pouvez désormais faire progresser et adapter les méthodes de criblage pour les modèles 3D pertinents d’un point de vue physiologique qui imitent plus fidèlement les états pathologiques des patients et les organes humains, ce qui permet d’accélérer le développement et l’approbation des médicaments.
Développement de lignées cellulaires
Nos clients qui développent des lignées cellulaires accélèrent la mise sur le marché d’anticorps monoclonaux (mAb) et de la médecine génomique, et effectuent des recherches révolutionnaires dans le domaine des thérapies cellulaires et géniques, de l’ingénierie génétique, de la médecine personnalisée et de précision, de la biologie de synthèse, des vaccins à ARN et ADN, et bien d’autres encore, grâce à notre technologie innovante et à notre vaste expertise.
Criblage de médicaments
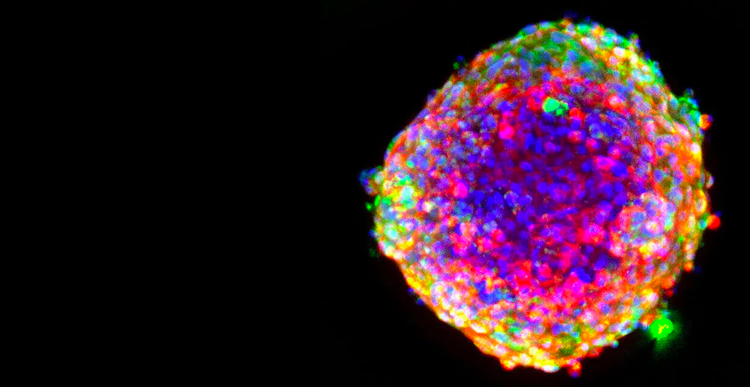
Pour chaque médicament qui parvient à la ligne d’arrivée, neuf autres échouent. Ce taux d’échec alarmant peut être attribué à la dépendance à l’égard des cultures cellulaires 2D qui ne reproduisent pas fidèlement la biologie humaine complexe, ce qui conduit souvent à des prévisions inexactes du potentiel d’un médicament et à des délais de développement longs.
Étape essentielle du processus de découverte de médicaments, le criblage de médicaments et l’évaluation de la toxicité identifient les effets de composés susceptibles de sauver des vies. Le passage aux tests cellulaires permet d’analyser rapidement plusieurs produits chimiques et représente mieux la biologie humaine.





